2014年02月04日
健康食品の機能性表示と市場性
■健康寿命の延伸と機能性表示
安倍政権は昨年6月、成長戦略の一環として、健康寿命の延伸と機能性表示の導入を打ち出した。健康寿命(図1)は男性で70歳(80歳)、女性で74歳(86歳)で、それぞれ、平均寿命との差である10年ほどは、人の手を借りたり、車椅子や寝たきりの期間になる。
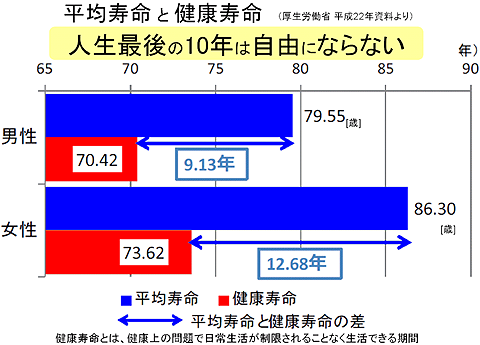
これを平均寿命の伸び率程度には、、健康寿命も伸ばそうというのが厚労省の政策だ。さらに、団塊世代の行動力に期待し、ロコモ対策などで、延伸を加速しようという取り組みも始まっている。行動力のある団塊世代で健康寿命の認知度が高まり、行動変容が起これは、予想以上の健康寿命の延伸が期待できるという指摘もある。
安倍政権では、健康長寿延伸産業、あるいは次世代ヘルスケア産業などの呼び名で、これらの産業が成長戦略の中核になるとして支援体制を整えようと動き出した。医療費、社会保障費の削減効果に加え、消費の拡大などが期待できる。
具体的な動きの一つは機能性表示の導入だ。「自分の健康は自分で守る。そのためには的確な情報提供が必要で、米国は機能性表示ができる」(安倍スピーチ)として、米国型の機能性表示制度の導入を宣言した。2015年春の市場導入に向けて、現時点では、出口だけが決まっている。

当面は3月24日の消費者意向調査の報告、昨年12月に発足した検討会の動向にかかる。経済効果についても、過去のケロッグ社の取り組みや、最近のトクホコーラなどの事例があるが、押し上げ効果は大きいと見られる。
健康産業界では、機能性表示以上に、健康寿命の延伸に同調する声は大きい。運動や栄養はそもそも予防的に位置付けられ、サプリメントも、基本的には予防的な利用が多い。緩やかな老化、視力の衰え、疲労感、免疫力の低下、運動能力の低下、これらに対して、機能維持、健康維持のニーズは高く、今後のサプリメント市場の中核になるとの期待は大きい。
■2020年、5兆円規模へ
今後の高齢者人口の増加、健康寿命の認知拡大とともに進む健康意識の向上、シニア層の購買力などを考慮すると、現在、トクホとサプリメントで2兆円近い売り上げは、当面5兆円を目指す動きになると見られる。第一に60歳以上のシニア人口の増加傾向か続くことがある。現在65歳以上で3,000万人の人口が、2030年には2~3割増加(図2)する。同時に、その層でのサプリメント利用は、他の年代層に比べ3~4倍に跳ね上がる(図3)わけで、相乗的な消費拡大が見込まれる。これに、政府の政策である機能性表示、健康長寿延伸産業の育成などが加わり、2020年で市場規模は現在の倍増、5兆円は射程距離にある。
■不当表示は厳しく規制
機能性表示制度が導入される一方で、不適切な表示はこれまで以上に締め付けが厳しくなる。
導入に先立ち消費者庁は、健康食品に特化した健康増進法・景品表示法上の「留意事項」を策定。違反となる具体例を明示した。「だんだん治る」といったダイレクトな表示だけでなく、消費者委員会がたびたび問題視していたいわゆる“イメージ広告”にくぎを刺す。「階段の昇り降りが楽々に!」「いつまでも若く」「テレビで紹介された」といった婉曲的な表示でも違反となる恐れがある。過去には「美容と健康に役立つ」といったありふれた表示が指導された実態も明らかになっており、「エビデンスなき機能性表示」については、新制度にかかわらず、厳しいチェックが行われることになる。
健康産業新聞 2014年1月1日 第1512号より
【消費者庁】食品の新たな機能性表示制度に関する検討会
安倍政権は昨年6月、成長戦略の一環として、健康寿命の延伸と機能性表示の導入を打ち出した。健康寿命(図1)は男性で70歳(80歳)、女性で74歳(86歳)で、それぞれ、平均寿命との差である10年ほどは、人の手を借りたり、車椅子や寝たきりの期間になる。

これを平均寿命の伸び率程度には、、健康寿命も伸ばそうというのが厚労省の政策だ。さらに、団塊世代の行動力に期待し、ロコモ対策などで、延伸を加速しようという取り組みも始まっている。行動力のある団塊世代で健康寿命の認知度が高まり、行動変容が起これは、予想以上の健康寿命の延伸が期待できるという指摘もある。
安倍政権では、健康長寿延伸産業、あるいは次世代ヘルスケア産業などの呼び名で、これらの産業が成長戦略の中核になるとして支援体制を整えようと動き出した。医療費、社会保障費の削減効果に加え、消費の拡大などが期待できる。
具体的な動きの一つは機能性表示の導入だ。「自分の健康は自分で守る。そのためには的確な情報提供が必要で、米国は機能性表示ができる」(安倍スピーチ)として、米国型の機能性表示制度の導入を宣言した。2015年春の市場導入に向けて、現時点では、出口だけが決まっている。

当面は3月24日の消費者意向調査の報告、昨年12月に発足した検討会の動向にかかる。経済効果についても、過去のケロッグ社の取り組みや、最近のトクホコーラなどの事例があるが、押し上げ効果は大きいと見られる。
健康産業界では、機能性表示以上に、健康寿命の延伸に同調する声は大きい。運動や栄養はそもそも予防的に位置付けられ、サプリメントも、基本的には予防的な利用が多い。緩やかな老化、視力の衰え、疲労感、免疫力の低下、運動能力の低下、これらに対して、機能維持、健康維持のニーズは高く、今後のサプリメント市場の中核になるとの期待は大きい。
■2020年、5兆円規模へ
今後の高齢者人口の増加、健康寿命の認知拡大とともに進む健康意識の向上、シニア層の購買力などを考慮すると、現在、トクホとサプリメントで2兆円近い売り上げは、当面5兆円を目指す動きになると見られる。第一に60歳以上のシニア人口の増加傾向か続くことがある。現在65歳以上で3,000万人の人口が、2030年には2~3割増加(図2)する。同時に、その層でのサプリメント利用は、他の年代層に比べ3~4倍に跳ね上がる(図3)わけで、相乗的な消費拡大が見込まれる。これに、政府の政策である機能性表示、健康長寿延伸産業の育成などが加わり、2020年で市場規模は現在の倍増、5兆円は射程距離にある。
■不当表示は厳しく規制
機能性表示制度が導入される一方で、不適切な表示はこれまで以上に締め付けが厳しくなる。
導入に先立ち消費者庁は、健康食品に特化した健康増進法・景品表示法上の「留意事項」を策定。違反となる具体例を明示した。「だんだん治る」といったダイレクトな表示だけでなく、消費者委員会がたびたび問題視していたいわゆる“イメージ広告”にくぎを刺す。「階段の昇り降りが楽々に!」「いつまでも若く」「テレビで紹介された」といった婉曲的な表示でも違反となる恐れがある。過去には「美容と健康に役立つ」といったありふれた表示が指導された実態も明らかになっており、「エビデンスなき機能性表示」については、新制度にかかわらず、厳しいチェックが行われることになる。
健康産業新聞 2014年1月1日 第1512号より
【消費者庁】食品の新たな機能性表示制度に関する検討会
「インチキ水素水」ブログ、「中傷だ」と日本トリムが研究者提訴
産経新聞が、事実に反する水素水の記事をコッソリ訂正
「水素水」効能うたう業者に改善要望 国民生活センター
マグロ過食に注意 妊婦から胎児へ影響
心停止の患者 水素で脳ダメージ軽減 臨床研究開始へ
ユニヴェールの水素サプリメント・ラヴィがリニューアル
産経新聞が、事実に反する水素水の記事をコッソリ訂正
「水素水」効能うたう業者に改善要望 国民生活センター
マグロ過食に注意 妊婦から胎児へ影響
心停止の患者 水素で脳ダメージ軽減 臨床研究開始へ
ユニヴェールの水素サプリメント・ラヴィがリニューアル
Posted by suiso at 08:04
│ニュース
│ニュース
この記事へのコメント
第1回 食品の新たな機能性表示制度に関する検討会 議事録
1. 日時
平成25 年12 月20 日(金)10:00~11:55
2. 場所
AP 東京八重洲通り KPP 八重洲ビル11 階 K+L 会議室
3. 出席委員
赤松委員、梅垣委員、大谷委員、合田委員、児玉委員、相良委員、清水委員、関口委員、津谷委員、松澤委員、宮島委員、森田委員
4.出席者(省庁関係者)
(消費者庁)阿南長官、山崎次長、川口審議官、竹田食品表示企画課長、谷口食品表示企画課課長補佐(総括)、塩澤食品表示企画課食品表示調査官
(厚生労働省)赤川医薬食品局監視指導・麻薬対策課長、長谷部医薬食品局食品安全部基準審査課長
(農林水産省)國井消費・安全局表示・規格課長、島田農林水産技術会議事務局研究推進課産学連携室長
5. 議事次第
1.開 会
2.阿南長官挨拶
3.食品の機能性表示制度をめぐる事情について
・現行の食品の機能性表示制度及び規制改革の経緯
・米国等における食品の機能性表示制度
4.今後の検討事項等及び進め方について
5.その他
6.閉 会
○消費者庁山崎次長 ただいまから第1回「食品の新たな機能性表示制度に関する検討会」を開催いたします。
初めに、消費者庁長官の阿南より挨拶を申し上げます。
○消費者庁阿南長官
本年6月14日に閣議決定されました規制改革実施計画及び日本再興戦略では、いわゆる健康食品等の加工食品及び農林水産物に関して、企業等の責任において科学的根拠をもとに機能性を表示できる新たな方策について今年度中に検討を開始し、来年度中に結論を得た上で実施します。これらの閣議決定を受けて、食品の新たな機能性表示制度の制定に向けた検討を行うために、学識経験者、消費者関連団体、事業者団体等で構成します「食品の新たな機能性表示制度に関する検討会」を開催することとし、本日、委員の皆様にお集まりいただきました。
消費者庁としては、食品の新たな機能性表示制度について、安全性の確保を前提とした上で、消費者の誤認を招くものではなく、自主的かつ合理的な商品選択に資する制度としたいと考えております。本検討会では、今回から毎月1回程度の開催を予定しております。来年夏ごろを目途に報告書を取りまとめたいと考えております。
タイトなスケジュールですが、委員の皆様に忌憚のない意見を賜りますよう、お願いします。
○消費者庁山崎次長 なお、阿南長官は公務のため途中で退席させていただきます。
続いて、お手元の別紙に委員名簿がございます。
なお本検討会は、オブザーバーとして厚生労働省と農林水産省からも出席いただいています。
○消費者庁山崎次長 それでは、議事に入りますが、まず、当検討会の開催要領(案)について、担当から説明します。
○消費者庁竹田課長
それでは、資料1の開催要領について説明させていただきます。
「第1 趣旨」です。
先ほど長官の阿南からもありましたけれども、本年6月14日に規制改革実施計画、日本再興戦略という2つの閣議決定がございまして、いわゆる健康食品等の加工食品、農林水産物について、企業等の責任において科学的根拠をもとに機能性を表示する新しい制度を25年度中に開始し、26年度中に措置、実施をするということが決められてございます。
これらの閣議決定を受けまして、消費者庁長官のもとで本検討会を設置いたしまして、既存の特保制度、栄養機能食品制度、こちらがありますけれども、それとは別に、機能性の表示を企業等の責任においてできる新しい制度をつくるために議論を賜りたいと思っております。
「第2 検討項目」です。
1つには、まず安全性の確保が第一ですので、安全性確保の在り方。それから、機能性の表示をしていただくに当たって、どのような科学的根拠が必要なのかといった考え方。最後に、消費者が誤認することのない表示の在り方について検討いただきたい。
「第3 スケジュール及び今後の進め方」です。
まず、現行の機能性表示制度、特保、栄養機能表示、それから米国のダイエタリーサプリメント表示制度など、こうした国内外の現状等を踏まえつつ、関係者からの意見聴取、ヒアリングなども踏まえながら、平成26年、来年の夏を目途に報告書をお取りまとめいただきたい。
「第4 委員等」です。
これは先ほど紹介させていただいたとおりです。座長は、消費者庁長官から指名をさせていただきます。座長代理は、座長に指名をいただきます。
「第5 運営」です。
先ほど紹介がございましたように、厚生労働省、農林水産省、それから消費者庁ということで本制度をつくっていくということになってございますので、両省の協力を得て消費者庁で担当してまいります。
(2)で、委員以外の関係者に御出席をいただいて意見をいただくということについては、適宜、座長の判断で、随時行っていきたいと思っております。
1枚おめくりいただきまして、本検討会については、原則公開で行います。
(4)にありますように、資料については、消費者庁のホームページで公表いたします。
「ただし」、検討に著しい支障がある、その他、正当な理由があると座長が判断された場合には、一部について非公表とすることも可能としております。
なお、検討会の議事録につきましては、各委員の御確認を得た上で、消費者庁のホームページに公表することを予定してございます。
この要領に定めるもののほか、議事の手続、進め方等につきましては、座長に判断いただき、お決めいただくことにします。以上です。
○消費者庁山崎次長 それでは、この開催要領(案)で、当検討会の座長ですが、これは消費者庁長官が松澤先生にお願いしてございます。
それでは、松澤座長から挨拶をお願いします。
○松澤座長 座長を突然指名されて、大変戸惑っているというのが現状です。私の専門は、糖尿病とか脂質異常とか動脈硬化、生活習慣病を専門としておりますが、症例には食というのが極めて必要で、私自身は日本の和食文化、今度世界遺産にもなりましたが、非常にそれが優れていて、それをいかにバランスよく食べることによってメタボリックシンドロームを予防することに重点を置いておりますので、必ずしも機能性食品というのにはあまり今まで造詣がなかったわけですけれども、ただ、津々浦々まで浸透している日本人の健康志向は、何か健康にいい食べ物を摂取したいという意欲につながり、それに対応して、極めて荒唐無稽な広告とか、そういういろんなものがはびこっている中で、今回こういう機能表示をある程度しっかりした形で承認するという必要性はあると感じておりますので、そういうことに関して枠組みというか、明確にしていければと思っております。以上です。
○消費者庁山崎次長 ありがとうございました。
それでは、これから松澤座長で議事の進行をお願いします。
○松澤座長では、これから私の司会進行により議事を進めます。
まず、当検討会の運営におきまして、開催要領にありますとおり、座長代理をあらかじめ指名することになっております。座長代理につきまして、私から指名させていただきます。座長代理は、現在、消費者委員会の新開発食品評価調査会の座長、厚生労働省の食品衛生分科会新開発食品調査部会の座長をされておりまして、この分野に大変知見のある寺本委員にお願いしたいと思います。寺本委員は本日御欠席ですが、どうぞよろしくお願いいたします。
それでは、具体的な議題に入りたいと思います。
本日は本検討会の初回ですので、まずは「食品の機能性表示制度をめぐる事情」ということで、現行の食品の機能性表示制度、本検討会を開催する発端となった規制改革の経緯、米国などの食品の機能性表示制度などについて、事務局から説明をします。
○消費者庁塩澤調査官 それでは、資料の説明に移ります。
まずは資料2-1「現行の食品の機能性表示制度及び規制改革の経緯」、こちらの資料から説明します。
それでは、ページをおめくりいただきまして、目次について説明させていただきます。
ここでは初めに、現行の食品の機能性表示の概要と食品の機能性表示の歴史について説明いたします。次に、栄養機能食品制度と特定保健用食品の概要について、さらに、このたびの閣議決定の背景と内容につきまして順に説明をします。
3ページ目、まずは「現行の食品の機能性表示制度」です。
現行制度におきましては、機能性表示を行える食品は大きく2種類です。1つ目は、下の図の中央部分にございます特定保健用食品、いわゆる特保です。特保につきましては、その摂取により当該保健の目的が期待できる旨の表示ができるのです。
そして、もう一つは、下の図ですと、特保の左側にございます栄養機能食品です。
こちらにつきましては、栄養成分の機能の表示をすることができるというものです。この特定保健用食品と栄養機能食品を保健機能食品と呼んでおります。この保健機能食品以外の食品におきましては、保健の機能や栄養成分の機能の表示をすることができないというのが現行制度の概要です。
4ページ目、こちらは「食品の機能性表示制度の歴史」です。
まず、昭和59年から61年におきまして、国レベルで機能性の研究がなされました。その結果、「食品の3次機能」、例えば生体の生理機能の変調を修復する働き、すなわち体調調節機能などが提唱されまして、機能性食品の概念が生まれております。
その後、検討が進められまして、平成3年9月に特定保健用食品制度が施行されております。そして、平成5年6月になりますと、この特保の許可第1号が誕生しております。
そして、平成13年になりますと、栄養機能食品が制度化されまして、錠剤、カプセル等の形状が食品として認められるようになりました。さらには、平成21年9月になりますと、消費者庁、消費者委員会の発足ということで、保健機能食品制度を含む食品表示の制度が消費者庁に一元化されております。ちょうどこのころから、健康食品の表示に関する検討会というのがなされておりまして、平成22年の8月に論点整理がされてます。
また、平成25年1月、今年の1月には、消費者委員会から健康食品の表示等の在り方に関する建議というものが示されております。また、平成25年6月には食品表示法が公布されています。今年ですけれども、ちょうど消費者委員会の建議が示されたころから、規制改革会議におきまして食品の新たな機能性表示についての議論がされ始めまして、6月14日になりますと、新たな機能性表示をつくっていくと閣議決定されています。
5ページ目、まずは「栄養機能食品」の制度の概要を説明いたします。
栄養機能食品とは、食生活において特定の栄養成分の補給を目的として摂取するものに対し、当該栄養成分の機能の表示をするものです。この栄養機能食品として販売するためには、1日当たりの摂取目安量に含まれる当該栄養成分量が定められた上・下限値の範囲内になければなりません。また、この制度につきましては、後に述べます特保のように、個別の許可申請を行う必要はございません。自己認証制度です。
表示の規定につきましては、その下のところに例として示しております。わかりにくいかもしれませんが、赤の太字で示しているところが表示事項として決められているものです。
6ページ目に「栄養機能食品の表示例」を載せております。
栄養機能を表示するための基準が定められている成分は現在17種類でございまして、具体的にはビタミン12種類、ミネラル5種類です。一部ですが、栄養機能表示及び注意喚起表示の例を下に表として示してます。この栄養機能表示及び注意喚起表示につきましては、原則定型文として定められてますので、一字一句変えてはいけないというのが基本です。
では、7ページ「特定保健用食品」の説明をします。
特定保健用食品とは体調調節機能を有する成分、すなわち関与成分を含み、健康増進法第26条第1項の許可を受け、その摂取により、特定の保健の目的が期待できる旨の表示、すなわち、保健の用途の表示ができる食品です。
下の※印のところに保健の用途の表示ということで説明をさせていただいておりますが、例えば「おなかの調子を整える、コレステロールの吸収を抑える、食後の血中中性脂肪の上昇を穏やかにする」等の表示がございます。
平成25年12月12日現在ですが、1,091件の食品が特定保健用食品の許可等を受けております。また、このページの真ん中から下のあたりに表示例を載せております。また、太字になっているところが特定保健用食品としての義務表示事項です。
このページの下側のところに「条件付き特定保健用食品」という言葉が出てますけれども、こちらは、通常の特保に比べるとやや科学的根拠レベルは劣るものの、一定の科学的根拠があるというものについて認められるカテゴリーとして用意しております。
8ページ「特定保健用食品に表示できる保健の用途(例)」です。
この特定保健用食品では、個別の食品ごとにその保健の用途に係る科学的根拠が明らかであるかどうかなどを審査し、表示できる内容を許可しているものです。
ここでポイントになるのは、個別の食品ごとに評価がなされるところです。
そして、用途の例ということで下に表を載せておりますが、例えば「おなかの調子を整える」ですとか、血糖値に関するもの、血圧、コレステロールに関するものなどがございます。この表の下から2つ目を御覧いただきたいのですが、疾病リスク低減表示というものがございます。こちらにつきましては、ほかとはちょっと種類が異なりまして、疾病名を書いて、そのリスクが低減するという可能性について表示できるのでございまして、例えばそこに挙げております、「骨粗鬆症になるリスクを低減するかもしれません」という表示ができるスキームです。
9ページ、こちらは「特定保健用食品の表示許可手続」です。
消費者庁長官が特定保健用食品の表示許可をするに当たっては、その安全性及び効果について食品安全委員会及び消費者委員会の意見を聴くということになっております。また、薬事法による表示規制の抵触の有無につき厚生労働省の意見を聴くことになってます。
下に許可手続の流れを示しておりますが、原則、事業者からの申請が、自治体などを経由して消費者庁の食品表示企画課に上がってきます。
次に、消費者委員会に諮られます。ここでは、新開発食品評価調査会というところで主に効果、すなわち有効性の評価がなされます。
続いて、食品安全委員会に回され、ここで主に新規の関与成分の安全性を中心に審査がなされます。
次に、また消費者委員会にいきまして、今度は新開発食品調査部会で改めて安全性と効果の判断がなされます。
さらに、厚生労働省の医薬食品局にいきまして、ここでは医薬品の表示に抵触しないかどうかのチェックがなされるという流れになっております。
さらには、国立健康・栄養研究所または登録試験機関におきまして、関与成分量が本当にそのぐらいの量入っているのかという分析がなされます。そして、問題ないということになると晴れて消費者庁長官の許可が下りるという流れになっています。
この図の下に、例えば「食品健康影響評価を行うことが必要ではない特保」という矢印がございます。こちらについては、既に例えばAという成分で100ミリグラムというのが仮に決められていたとした場合、それよりも下回る量で何か申請が上がってきたという場合、改めて安全性評価を必要としないという場合に、このようなショートカットの手続があるというものです。
「規格基準型特保及び再許可等特保」という矢印もございますけれども、例えば再許可というのは味違い品など、そういった場合にはこのような流れで審査が行われる場合があるというものです。
10ページ目「特定保健用食品の審査に要する資料」という説明です。
この特定保健用食品の審査に当たりましては、有効性及び安全性の要件ごとに医学、栄養学に基づく根拠となる資料の提出を求めているというものです。ここでポイントになりますのは、有効性及び安全性につきまして、特保では最終製品を用いてヒト試験を行うことが必要という点です。
具体的には、下の図の真ん中に上段と下段の囲みがございますけれども、まず、上段のところ、これが「食品及び関与成分に係る保健の用途を医学的・栄養学に明らかにした資料」という説明ですが、真ん中あたりを見ていただきますと「ヒトを対象とした試験を実施し」という記載がございます。
有効性に関する試験については、その下ですが、「試験デザインについては、結果の客観性を確保する観点から、プラセボ食品摂取群を対照とした比較試験とする必要がある」というものになっております。
下の四角、安全性についてですが、こちらにおきましてもヒト試験が必要でして、過剰摂取試験、長期摂取試験、これが必要になってくるというものです。
右側の四角の上2つですけれども、この安全性ですとか有効性に関するような資料につきましては、「可能な限り最新の知見に基づいたものとし、医学・栄養学等の学術書、学術雑誌等に掲載された知見を含むものとする」ということになっております。
ヒト試験の被験者は、健常人から疾病の境界域のものに至るまでの範囲で目的とする保健の用途を対象として適切なものとするとなっておりまして、例えば下に例として示しておりますけれども、保健の用途ごとにデザインが推奨されておりまして、コレステロール関係、中性脂肪関係、体脂肪関係、血圧関係などで、こちらに示しているようなデザインというものを推奨しているというものです。
11ページ、こちらから規制改革会議の説明等の資料となります。
左側、現状ですけれども、先ほど申し上げたとおり、現行制度では機能性が可能なものは以下の2つでございまして、それ以外は機能性表示が不可となっております。
現行制度のイメージ図を中段に示しておりますが、この太く囲ったところ、すなわち栄養機能食品と特定保健用食品のみ機能性表示が可能というのが今の制度でして、いわゆる一般の食品、こちらについては機能性表示ができないというのが現行制度です。
こういった現状に対して、例えば栄養機能食品につきましては、対象成分が栄養成分に限定されているという指摘がございました。また、特定保健用食品につきましては、食品ごとに有効性や安全性に係るヒト試験が必須と先ほど申し上げましたけれども、このようなことになっておりますので、この許可手続に時間ですとか費用、そういったコストがかかるということで、特に中小事業者にあってはハードルが高くなっているという指摘がかねてよりございました。
このようなことに対して規制改革会議で議論がなされまして、規制改革会議におきましては、病気や介護を予防し、健康を維持して長生きしたいという国民のニーズがあること、また、我が国として世界に先駆けて健康長寿社会を実現したいという観点から今回の閣議決定がなされております。
すなわち、加工食品及び農林水産物について、企業等の責任で科学的根拠をもとに機能11
性を表示できる新たな方策を検討。今年度から検討を開始し、来年度、すなわち平成27年3月末までにそれを実施するということが示されております。
また、この検討に当たりましては、米国のダイエタリーサプリメントの表示制度を参考にすべきということ、また安全性の確保もしっかり考えていくということが、今年6月14日の閣議決定で示されております。
この制度が実現した場合のイメージ図を下に示しているのですけれども、新たに一般食品の一部が一定要件を満たせばという条件付きではございますが、事業者責任で機能性表示が可能になるというものです。まさに、この一定要件というものは、今後委員の皆様方に議論いただくところです。
12ページにおきましては、6月14日の閣議決定、こちらの文章を示しております。
具体的な説明は割愛させていただきます。
以上が現行制度、それから規制改革の経緯の説明です。
続きまして、資料2-2の説明に移らせていただきます。
こちらの資料につきましては、「米国等における食品の機能性表示制度」の説明です。
2ページ目の目次です。
この資料では、まず米国の健康強調表示制度がそもそもどうなっているかという説明を差し上げます。次に、ダイエタリーサプリメントの表示制度、そして、この制度について指摘されている問題点の例を紹介いたします。また、参考といたしまして、EUでは健康強調表示制度がどうなっているかという説明とコーデックスガイドラインにおいての健康強調表示の規定というものも紹介させていただきます。
3ページ目「米国の健康強調表示に関する制度」の説明です。
米国におきましては、表示の種類、大きく2つございます。
まず、1つ目が疾病リスク低減表示、そして構造機能表示、この2種類です。
疾病リスク低減表示につきましては、これは国、すなわち食品医薬品局(FDA)が管理しているものでございまして、事業者が自由にできるという制度ではございません。この制度、これも大きく2つ分かれまして、一つはヘルスクレーム、もう一つは条件付きヘルスクレームというものがございます。
上のヘルスクレームにつきましては、栄養成分、その他成分、特定の食生活、運動等と疾病リスク低減の関連性に関する表示でございまして、専門家の間に十分な科学的な合意、しっかりした科学的根拠があるということが条件になっております。
表示例といたしましてそちらに示しておりますけれども、「健康的な食事の一環として、適切なカルシウムとビタミンDを摂取すると同時に身体活動を行うことで、その後の人生における骨粗鬆症のリスクを低減することがあります」などが既に認められている表示としてございます。
次に、条件付きヘルスクレームですけれども、こちらの内容はほぼ上と似通っているのですが、ただ、ヘルスクレームよりも科学的根拠レベルが低いものとなっておりまして、科学的根拠レベルに応じて3段階の機能表示が設定されています。ここにはB、C、Dと概念としてありますけれども、3段階用意されております。
表示例として、例えば「セレンは前立腺がんのリスクを低下させる可能性があります。
本クレームに関する科学的根拠は決定的なものではありません。そのレビューに基づいてFDAはセレンが前立腺がんのリスクを低下させる可能性があることには同意していません」などのように条件付きの記載であるというのがこの制度の特徴です。
また、下ですけれども、構造機能表示は、まさにこれから説明の対象となるダイエタリーサプリメント制度です。こちらについては、国が一定のルールはつくってはおりますが、原則事業者の自己責任で表示が行える制度です。詳細は次のスライドで示します。
4ページ目、こちらが「ダイエタリーサプリメントの表示制度」の概要です。
実際に売られている製品の表示見本を例に概要説明をさせていただきます。
まず、赤で囲っております特徴①ですが、この制度では、事業者の自己責任で機能性の表示ができるものです。ただし、疾病リスク低減表示は禁止でして、疾病名を記載することは、一部例外はあるのですけれども、基本的には禁止です。もちろん、医薬品的な表示を書くことも当然禁止です。下に実際の表示例を示しております。
次に、特徴②ですが、この特徴①のような機能性表示を行う場合の規定ですけれども、国の評価を受けたものではない旨及び疾病の治療等を目的としたものではない旨の表示が必須となっておりまして、これは定型文として決められております。このような表示を行わなくてはいけないというのが特徴です。
また、特徴③に示してますが、ダイエタリーサプリメントにつきましては、形状の規定がありまして、例えば錠剤、カプセル、粉末、ソフトジェル、液体等のサプリメントのようなものに限定されております。
次に、販売後30日以内にFDAに製品情報を届出しないといけないとなっております。これにつきましては、特徴①に示しているような機能表示を行うという場合のみの規定です。
3番目に、新規成分に該当するようなものを使用したい場合には、これは事後ではなくて、販売の75日前までに企業がみずから安全性評価を所定のスキームにのっとって行い、それをFDAに届け出ないといけない規定になっております。
4番目ですが、有害事象発生時の連絡先の表示が必要という規定もありますし、有害事象発生時は、事業者からFDAに対して速やかに通告をしなくてはいけない規定もございます。有害事象情報はFDAなどのウェブサイトで公表されることになっております。そして、製品リコールに関する規定も用意されているというのがこの制度の概要です。
このようなダイエタリーサプリメント制度ですが、いろいろな問題点も指摘されておりまして、次の5ページですけれども、これはアメリカの政府内部からも指摘されている問題点の例として、一部ではございますが、示しております。
まず、第一に、有効性の実証に当たり考慮すべきとされている点が十分に考慮されていない可能性について示されています。こちらについては、保健福祉省監察総監室というところのレポートに示されているのですけれども、保健福祉省というのは、FDAの上位機関にあたるところでございまして、こちらが下の出典のところに示しておりますとおり、2012年にレポートを出しております。このレポートに示されている内容ですが、体重減少及び免疫機能に関する製品127品を対象に表示の適切性を調査した結果、事業者から提出されたヒト研究が557件ありまして、それについて調べたところ、有効性に関する表示内容の実証に重要と示されている4つの観点を全て考慮したと考えられるものは1つもなかったということが示されております。
この4つの観点というのは、有効性に関する事業者向けガイダンスというのがあるのですけれども、そちらに示されている観点でございまして、具体的には、表示の意味、表示とそのエビデンスとの関連性、エビデンスの質、そしてエビデンスの総合性、Totality of Evidenceという単語がありますけれども、こちら4点を考慮するのが重要というように示されております。
このTotality of Evidenceということについてはどんなものかといいますと、関連する研究を見る場合に、いいとこ取りするというのはよろしくありませんので、関連する論文などにつきまして肯定的、否定的内容を問わず、全て網羅的に収集して検討する。そして、総合的観点から肯定的と言えるのか、否定的で言えるのかを判断するというのがこのTotality of Evidenceの考え方です。
2つ目に挙げておりますけれども、事業者から提出されたこの557件のヒト研究のうち、否定的データであったのは4%にすぎなかった。先ほど申し上げたTotality of Evidenceという考え方のもと、肯定的であろうが、否定的であろうが、網羅的に収集するということをやれば、通常ですと否定的なのが4%しかないというのが考えにくいのではないかと。
もちろん、この4%が直ちにだめというわけではございませんが、通常では否定的が4%というのは考えにくいというものです。
また、この557件のうち、約半数である49%におきましては、当該製品の摂取が想定される集団ではない集団を対象とした研究でありまして、そもそも、これがエビデンスとして使えるのかどうか疑問である可能性が示されております。
6ページ、問題点その2ですが、不適正な表示により消費者の誤認を招く可能性も指摘されております。先の調査におきましては、7%の製品で記載が必須とされている免責表示、これは正しくはdisclaimerという英語で打ち消し表示という意味ですけれども、この打ち消し表示、免責表示が表示されていなかった実態がございます。
この免責表示というのは、先ほど示した下の括弧に記してある内容です。こういったものが7%の製品には記載されていなかった実態が挙げられてます。
また、20%の製品においては、本来、禁止されているはずの疾病に関する表示がなされていたということが挙げられております。
下の囲みのところですが、有害事象発生時の連絡先が表示されていなくて、健康被害の拡大防止が十分に図れない可能性も指摘されております。具体的には、20%の製品で有害事象発生時の連絡先が表示されていなかったというのが事実として挙げられてございます。
以上がダイエタリーサプリメント制度の説明です。
7ページ、ここからは参考情報ですけれども、初めにEUの健康強調表示に関する制度の説明をします。
EUにおきましては、表示の種類は大きく3つほどございまして、1つは構造機能表示、次に疾病リスク低減表示、また小児健康表示、この3種類がございます。ただ、許認可の主体におきましては、EC、EFSAなど示しておりますけれども、全て公的機関が管理していまして、アメリカのダイエタリーサプリメント制度のように事業者責任でできるものではございません。
構造機能表示におきましては、大きく分けると2種類ありまして、1つは13.1条クレーム、次に13.5条がありまして、13.1条は古典的な栄養素ですとか、一般的な成分が対象になるような制度です。表示例もそこに示しております。13.5条というのは、基本的には新規成分が対象になるような制度です。
次に、疾病リスク低減表示と小児健康表示につきましては、14条クレームというものがありまして適切な評価がなされるというものであり、表示例もそこに示しております。
8ページ、こちらはコーデックスガイドラインにおける健康強調表示の規定です。この健康強調表示の使用の国際ルールにつきましては、コーデックス食品表示部会というところで主に議論がなされまして、2004年に栄養及び健康強調表示の使用に関するガイドラインというのが採択されております。
このガイドラインを補完する健康強調表示の科学的実証に関する勧告というものがコーデックス栄養特殊用途食品部会というところで議論がなされまして、2009年に採択されているというものです。
なお、コーデックスというものは何かと申しますと、国連食糧農業機関、そして世界保健機関によって1962年に設立されたものでありまして、消費者の健康保護と公正な食品貿易の確保を目的とした組織です。現在、185の国とEUが参加して、もちろん我が国も参加しております。
下に、このガイドラインにおいてどのような健康強調表示の定義がなされているかなどを示してますが、ここでいうヘルスクレームとは、この下の3つ、すなわち栄養素機能強調表示、その他の機能強調表示、疾病リスク低減表示、これを全てまとめてコーデックスはヘルスクレームという具合に呼んでおります。
ここで1つ注意が必要なのは、コーデックスでは疾病リスク低減表示まで含めてヘルスクレームと呼んでいる点です。他方、先ほど申し上げたアメリカの制度におけるヘルスクレームとなりますと、疾病リスク低減表示のうち最も科学的根拠レベルは高いもの、それのみをヘルスクレームとしておりますので、アメリカで言うヘルスクレームとコーデックスで言うヘルスクレームは違うのだと承知いただければと思います。
次に、右側ですが、健康強調表示の科学的実証に関する勧告で、やや技術的なところが載っておりますけれども、重要な点を2点ほど紹介いたします。
上から3つ目ですが、入手可能なエビデンスの総合性を評価するというものが健康強調表示の実証プロセスとして挙げられております。このエビデンスの総合性というのは、まさに先ほど申し上げたTotality of Evidenceでありまして、コーデックスでもこの考え方が重視されているというのがまず特筆すべきところかなと思います。
次に、健康強調表示の実証の基準というところに、十分に設計されたヒト介入試験によって提供される根拠に基づくべきというのが挙げられております。
ここには示していないのですけれども、このコーデックスでは介入研究に基づくべきとなっていまして、ヒト観察研究のような介入ではないようなヒト試験、それのみをもってはエビデンスとしては不十分という記載もございます。
なお、ダイエタリーサプリメント制度におきましては、詳しくは今後、次回以降で説明いたしますけれども、どのようなエビデンスが必要かというところで、ガイダンスで示されていると、ヒト研究が必要とはなっているのですが、介入試験、そのうちダブルブラインドのRCTという非常に質が高いものがあるのですけれども、こちらについてゴールドスタンダードとなっております。ただし、アメリカでは観察研究のようなものについても適切に行われているのであれば差し支えないという規定になっているという点がコーデックスとアメリカで若干異なる点です。こちらについては先ほど申し上げたとおり、次回以降に詳しく述べます。
以上、駆け足で米国等における食品の機能性表示制度の説明をさせていただきました。
○松澤座長 どうもありがとうございました。
今後の検討に当たり、留意すべき点や検討の方向性などについては、資料3を説明いただいた後に、長めの意見交換の時間をとります。
まずは、ただいまの事務局からの説明を受けまして、現行制度などについて不明の点や質問がございましたら。どうぞ。
○大谷委員 最後に説明いただきましたコーデックスのガイドラインというのは、各国で検討するときにどのぐらいの拘束力があるものなのでしょうか。
○消費者庁塩澤調査官 コーデックスについては、強制力はございません。強制力はないのですけれども、各国とも正当な理由がない限り、それを参考にしていろいろな制度をつくることになっております。コーデックスが効力を生じるとすれば、例えばある国が正当な理由なくしてコーデックスの考え方よりも意図的に何か過度に厳しい規定を設けていた場合に、例えばほかの国と貿易上の問題が起きたという場合に、そのコーデックスのガイドラインなどに基づいているかどうかが非常に重要なものになってくると、そういった意味での効力はございます。
ただ、国際的な議論の末、いろんなガイドラインなどがつくられておりますので、各国ともコーデックスで示されているものは重視しているのが現状です。
○松澤座長 いかがでしょうか。どうぞ。
○津谷委員 同じく資料2-2のコーデックスのところですが、定義で「健康強調表示(Health claim)」とあります。ここは「Health claim」を日本語の「健康強調表示」に訳してあり、一方、その前にある米国のところではそのまま「ヘルスクレーム( Health Claims)」と片仮名で書いてあるのですが、意図的に使い分けているのでしょうか。
○松澤座長 いかがでしょうか。
○消費者庁塩澤調査官 意図的に書き分けております。先ほど申し上げたとおり、ややもすると、アメリカのヘルスクレームとコーデックスが言っているヘルスクレームは混同してしまう可能性もありますので、何らか書き分けが適切であろうと考えております。
○松澤座長 よろしいですか。
○津谷委員 もう一点。いずれ話が出てくるかと思うのですが、関連する領域で、通常の医薬品の場合にrisk reductionという用語は米国やEUで使われているのでしょうか。例えば日本では、アスピリンは心筋梗塞の再発を予防するとは添付文書には書いていなくて、血栓生成を抑制するような表現になっています。米国ではダイエタリーサプリメントのみがrisk reductionという言葉を使って、医薬品は使わないのでしょうか。回答は今日でなくてもよろしいです。
○消費者庁塩澤調査官 医薬品についてはわかりかねますので、調べます。
○松澤座長 いかがですか。
○厚生労働省赤川課長 医薬品につきまして、今、アスピリンの例が津谷委員から指摘がございましたけれども、いわゆる抗凝血作用につきましては、現在は表示といいますか、いわゆる薬事法上の承認の対象になっております効能または効果として認められておりますので、これは長い100年以上使用されているものですので、それまでに得られている科学的エビデンスをもとに、医学薬学上公知であるものとして承認された経緯がございます。これは、ここ十数年ぐらいの話です。
○松澤座長 では、津谷委員、どうぞ。
○津谷委員 以前、低用量アスピリンは小児用が出ていて、それを心筋梗塞の再発予防に適応外で使っていたのを1999年の2課長通知でもって適応を追加したということがありました。ただ、追加したときの適応の書きっぷりが、予防とかリスク低減とは書いていないですね。今おっしゃったような表現、具体的には忘れましたけれども。ですから、私の質問は、そういうリスク低減というような明確なコンセプトが医薬品で使われているかどうかなのです。
○松澤座長 よろしいでしょうか。どうぞ。
○清水委員 直接的な答えにならないかもしれないのですけれども、まず、prevention、予防は医薬品しか使えない、食品には使えないということで、risk reductionという言葉が食品に使っていい言葉として使われました。このようなpreventionに近い言葉として使われてきたのは、私の記憶ではEUのプロジェクトで「PASSCLAIM」というプロジェクトがあるのですが、その中で、食品に使用する言葉として公的に使われたと記憶しております。
preventionは医薬品のみに使え、食品には使えない。それに近い言葉としてrisk reductionという言葉を提案したということだと思います。
○松澤座長 どうぞ。
○津谷委員 細かいことで申しわけないのですが、日本ではpreventionに相当する予防という用語は医薬品においても使えない場合があるという話を聞いたことがあるのですが、後日でよろしいですので、お教えください。
○松澤座長 今後のこちらの進め方の中での話ですから、それで時間をとると問題ですけれども、私自身が座長をして、こんなプリミティブな質問をしていいかどうかという点はありますが、今回の検討は食品の機能性表示ですが、食品の定義があまり明確でなくて、今みたいに薬と共通の問題点のようなディスカッションになるというのは何となく違和感があるのですけれども、米国のものがサプリメントとかそういう話になっているのですけれども、基本的にはここで検討すべき食品の機能は、どういうイメージがあるものが出てくるのですか。やはりタブレットになってこういうものを薬ではないから食品として、それについての機能を論じるということですか。そうしたら、薬についての今のディスカッションがそうであるように、薬の評価とか安全性というと同一になるような感じがするのですけれども、そこのところをもう少し明確にしておいたほうがいいと思います。
○消費者庁塩澤調査官 今の答えですけれども、先ほどの説明でも差し上げましたが、このたび閣議決定で決められていることが何かと申しますと、加工食品、農林水産物となっておりまして、これは言ってみますと、全ての食品が対象になり得ます。
つまり、通常の食事に出てくるようなもの、例えば生鮮食品ですとか、普通の加工食品ですとか、あるいはいわゆるサプリメント形状をしているようなもの、こういったものにつきましても、医薬品ではない限り、食品であれば全て対象になり得るというのが今回の閣議決定の内容ですので、こういった食品についてどのようなルールを設けるべきかが皆様方に審議いただく内容です。
○松澤座長 サプリメントの中で、こういうタブレットも食品ですか。
○消費者庁塩澤調査官 そうです。
○松澤座長 わかりました。ほかに。
○合田委員 4ページ目のダイエタリーサプリメントの表示制度のところで教えていただきたいのですが、このような表示ができる場合に、エビデンスそのものと表示との関係というのか、その商品ではなくても米国は表示できる、その商品のものでなくてもエビデンスがあれば表示ができると、そのように考えてよろしいですか。それとも次のところの5ページ目の関係になると思いますけれども、4つの観点をうまく総合的に判断して、よければ表示ができると考えてよろしいですか。教えていただければと思います。
○消費者庁塩澤調査官 今の答えですが、結論を先に申し上げると、売ろうとしている最終商品でなくとも差し支えございません。こちらは後に有効性のところの議論をいただくときに、こちらから有効性の考え方がアメリカでどうなっているかは詳細には説明しますけれども、アメリカでは何をもって有効性と考えるかについての事業者向けのガイダンスが示されております。その中を見ますと、できれば最終製品を対象にエビデンスがあることが重要とはなっているのですが、それがないといけないという規定にはなっておりません。成分ベースとかでも説明がつくのであればエビデンスとして差し支えないという整理になっておりますので、特定保健用食品のように最終製品をもって評価したものでないものはだめという考え方になっていないのがアメリカの制度です。
○松澤座長 よろしいですか。どうぞ。
○合田委員 全く具体的になり過ぎるのかもしれないのですけれども、有効成分があって、実際にそのものが例えば錠剤、カプセルなどの場合には、そういうものが崩壊しない状態も当然出てきますよね。その辺のところの何かガイドラインとか、そういうレベルまで規定をされていますか。実際に成分のレベルというのは非常にやりやすいのですけれども、形状が食品であればまた別ですけれども、こういう錠剤とかカプセルの形状ですと、そこまで考えないと具体的に結果がつながらない可能性は高いと思います。
○消費者庁塩澤調査官 崩壊性とか、溶解性につきましては、今後、詳細に調べた上で、しかるべき議論のときにそういった情報提供もさせていただきます。
○松澤座長 今後、我々の規定の中でそういうことを検討していくということだと思います。どうぞ。
○赤松委員 今のところに関連しますが、ダイエタリーサプリメントの4つの観点がそろうと栄養成分として認められるぐらい厳しいのではないかと思います。アメリカでは、ヘルスクレームでのエビデンスとここに挙げられている4つの観点のエビデンスの差はどれぐらいあるのか教えていただけますか。
○消費者庁塩澤調査官 これも具体的な話になりますので、そういった議論をするときに詳しく示しておきますけれども、確かにアメリカではヘルスクレームに関するエビデンスの要件というガイダンスと、ダイエタリーサプリメントに特化したガイダンスを分けて設けられておりまして、そのヘルスクレームのほうのガイダンスについては、それこそRCTに関する詳細な説明とかそういったのが示されておりますので、そういう意味では、このダイエタリーサプリメントとヘルスクレームのほうのガイダンスの書き分けが若干なされています。具体的には、また今後の議論のときに示させていただきます。
○松澤座長 どうぞ。
○児玉委員 私も4ページ、5ページ、6ページ目ぐらいですか。アメリカで2012年にこれだけちゃんと守られていない食品が市場に出ていることが調査されたと思うのですけれども、そういうのは例えば野放しにすると、何か規制があってそういう商品はまたサプリメントの表示を剥奪するとか、何かそういう事後処置的なものはアメリカの制度にはあるのでしょうか。
○松澤座長 どうそ。
○消費者庁塩澤調査官 不適切なダイエタリーサプリメント製品があった場合は、もちろん、しかるべき措置などができることになっていまして、それも詳しくはまた後に紹介します。
○松澤座長 そういうことで、大体今諸外国、アメリカを中心とした事情がわかったことで、これについてどうするかという問題ではなくて、こういうのが今行われていて、これは十分な制度かどうか、このとおりやるというわけでは我々はないわけで、参考にしながら日本でしっかりとした今のディスカッションになった問題点をクリアしていきたいと思っております。
続きまして、検討会の今後の検討事項及び進め方について、事務局から説明をお願いします。
○消費者庁塩澤調査官 それでは、続きまして、資料3-1の説明をさせていただきます。
資料3-1は、「今後の検討事項等」の資料です。
目次にまず、この資料におきましては、新制度に向けての基本的な考え方を紹介して、さらに、今後この検討で想定される主な論点を紹介します。また、この食品の機能性表示に関する消費者意向等調査を現在行っているのですけれども、この概要についても説明しつつ、最後に、新たな機能性表示の実施に向けたスケジュールを紹介いたします。
それでは、3ページ目「新制度に向けての基本的な考え方」ということで、我々として新制度に向けてどのように考えているのかを図示化したものです。
まず、我々としては、一番上にあります安全性の確保、これが何といっても大前提と考えております。
また、左下に示しておりますが、機能性表示を行うに当たって必要な科学的根拠の設定もしっかり行っていく必要があると考えておりますし、右側、適正な表示という仕組みをしっかりつくりまして、消費者への情報提供が適切に行われることもきちんと考えていきたい。
この3点を十分考えていくことによりまして、中央部分に示しております消費者の誤認を招かない、自主的かつ合理的な商品選択に資する表示制度をつくっていきたいと考える次第です。
4ページ目、こちらは今後想定される主な論点です。
大きくは3点ほどありまして、1つ目は安全性の確保、次に機能性の表示、また、食品表示制度としての国の関与、この3点が大きな論点です。
「安全性の確保」については5点ほどありまして、1つ目は、対象となる食品、成分の範囲をどう考えるかという点。2つ目として、生産・製造及び品質の管理、これもどう図っていくかという点。また、3つ目に摂取量の在り方、これをどう考えていくのかも重要な論点と思っております。
4つ目に、健康被害等の情報収集、こちらも非常に大事になってまいりますし、また、5つ目の危険な商品の流通防止措置をどう講じていくかも重要かと思っております。
「機能性の表示」の論点ですけれども、1つ目は、企業等がみずから機能性を評価する際の科学的根拠レベルをどこに置くかという点も重要かと思っておりますし、あとは適切な機能性表示の範囲、つまり、どの程度までの書きぶりを機能性表示に認めるかという点も重要かと思います。消費者に誤解を与えないための情報の在り方、つまり表示の仕組み、表示の在り方をどう考えるかも重要と考えます。
「食品表示制度としての国の関与」ですけれども、1つ目は、安全性の確保、機能性の表示の適切性を担保するための仕組み、手続、これをどう考えるかというのも重要と思っておりますし、また、関係省庁の役割分担も重要になってくるかと思っております。
以上の大きく3点、これをしっかりと考えていくことによって、上と下の囲み、すなわち上のところは、国ではなく企業等がみずから科学的根拠を評価した上で、その旨及び機能を表示できる制度というもの、こういう制度と、下に挙げております消費者の誤認を招かない自主的かつ合理的な商品選択に資する制度、これが両立し得るものと考えております。
5ページ目、こちらは「食品の機能性表示に関する消費者意向等調査」の概要です。こちらの調査は、平成25年度、つまり、今年度の消費者庁調査事業で現在行われているもので、受託事業者は株式会社インテージリサーチです。
背景としては、先般の閣議決定で新たな機能性表示制度をつくることが示されたのですが、先ほども述べましたとおり、参考にすべきとされているアメリカの制度には、種々の問題点も指摘されてますので、その種々の問題点を検討し、それを何とかクリアしていく知見を得ていきたいのがこの調査の主眼です。
真ん中の目的は、消費者の誤認を招かず、消費者の自主的かつ合理的な商品選択に資するような機能性表示制度を検討するための基礎資料を得ることを目的に、大きく2つ、今回は取り組んでおります。「① 米国ダイエタリーサプリメント制度に関する課題等整理」。そして「② 機能性表示に関する消費者の読み取りに関する実態調査」の二本柱です。
下の概要ですが、まず1つ目、課題等整理のところですけれども、米国のダイエタリーサプリメント制度については、我々としては、現在、英語の原文に当たるなどして制度の把握に努めておりますけれども、こちらについてもきちんと関連の法令とか指針とか、レポート、論文などを収集して適切に和訳しておく必要があるだろうと、和訳をやっております。
また、この和訳の結果などをもとに、有効性、安全性表示方法等の観点から、新たな表示制度の検討に当たり、留意すべき点を図とか表などを用いることもあわせまして、わかりやすく整理していくことがここでの取組です。
続きまして、「② 機能性表示に対する消費者の読み取りに関する実態調査」です。
この誤認を防ぐ制度の在り方に関する知見を得ることを目的に、今回は機能性表示に対する誤認率が高いと想定される集団、具体的には高齢者、病者、疾病予備軍も含めまして、こういった方々や、妊婦さんですとか妊娠計画中の人、そして乳幼児の保護者ですとか未成年者等を対象にグループヒアリングを実施してまいります。
具体的には、アメリカの製品を和訳した見本などをテーブルの上に広げるなどして、こういった機能性表示に関する誤認率が高いであろうと思われる人たちに、このアメリカのような食品が出てきた場合に、どういう点で誤認が生じ得るのか。逆にいいますと、どうすればこういった方々でも誤認しないのかという点を丁寧に探っていきたいと考えております。
こちらの結果を踏まえて、次の○に書いておりますけれども、インターネット調査を行っていきたいと考えております。先ほどのグループヒアリングにつきましては、やはり人数の制約というものもございますので、このインターネット調査、3,000人ぐらいの規模で行うということによって、グループヒアリングで得られた知見の数的な担保を図っていきたいと考えております。
以上の結果を踏まえて、私どもとしては、具体的な制度案、たたき台案をつくりまして、この検討会の場においてそれを示して、皆様方にいろいろな立場、いろいろな観点から議論いただき、制度につなげていきたいと考えております。
次のスライドに移りますが、具体的な制度の実施に向けたスケジュールを示しております。上の四角のところ「本検討会での議論」が、まさにこの検討会のスケジュール案でして、前半は安全性の確保に関する検討を主に行ってまいりたいと考えております。そして、後半以降においては、先ほど申し上げた消費者意向等調査、それをもとにしたたたき台案をこちらに示して、機能性の評価、また表示の在り方などについて議論いただきたいと考えております。
何とか来年の夏ぐらいまでにこの議論を取りまとめまして、その後「法令等改正」となっておりますけれども、消費者委員会に意見を聴取したり、パブリック・コメントという形で国民の皆様方に広く意見を聴取することを行って制度を固めまして、その後、広く周知期間というのを設けまして、何とか平成26年度末までに新たな制度を始めたいと考えております。
続きまして、資料3-2「今後の進め方(案)」です。
第1回目は今回ですけれども、背景説明、それから今後について、そういった内容で行いたいと思っております。
2回目以降から各論の話に入ってまいりまして、第2回、第3回、第4回ぐらいで安全性の確保について議論賜りたいと考えております。
そして、第4回目の途中ぐらいから第6回目ぐらいまでに機能性の評価及び表示の在り方についての検討などをしていただきまして、第6回目では国の関与の在り方なども議論いただきたいと考えております。
そして、第7回、第8回と大体2回ぐらいでこの検討会としての取りまとめを行っていただき、何とかこの議論を固めていきたいと思っております。
以上が資料3-2の説明です。
1. 日時
平成25 年12 月20 日(金)10:00~11:55
2. 場所
AP 東京八重洲通り KPP 八重洲ビル11 階 K+L 会議室
3. 出席委員
赤松委員、梅垣委員、大谷委員、合田委員、児玉委員、相良委員、清水委員、関口委員、津谷委員、松澤委員、宮島委員、森田委員
4.出席者(省庁関係者)
(消費者庁)阿南長官、山崎次長、川口審議官、竹田食品表示企画課長、谷口食品表示企画課課長補佐(総括)、塩澤食品表示企画課食品表示調査官
(厚生労働省)赤川医薬食品局監視指導・麻薬対策課長、長谷部医薬食品局食品安全部基準審査課長
(農林水産省)國井消費・安全局表示・規格課長、島田農林水産技術会議事務局研究推進課産学連携室長
5. 議事次第
1.開 会
2.阿南長官挨拶
3.食品の機能性表示制度をめぐる事情について
・現行の食品の機能性表示制度及び規制改革の経緯
・米国等における食品の機能性表示制度
4.今後の検討事項等及び進め方について
5.その他
6.閉 会
○消費者庁山崎次長 ただいまから第1回「食品の新たな機能性表示制度に関する検討会」を開催いたします。
初めに、消費者庁長官の阿南より挨拶を申し上げます。
○消費者庁阿南長官
本年6月14日に閣議決定されました規制改革実施計画及び日本再興戦略では、いわゆる健康食品等の加工食品及び農林水産物に関して、企業等の責任において科学的根拠をもとに機能性を表示できる新たな方策について今年度中に検討を開始し、来年度中に結論を得た上で実施します。これらの閣議決定を受けて、食品の新たな機能性表示制度の制定に向けた検討を行うために、学識経験者、消費者関連団体、事業者団体等で構成します「食品の新たな機能性表示制度に関する検討会」を開催することとし、本日、委員の皆様にお集まりいただきました。
消費者庁としては、食品の新たな機能性表示制度について、安全性の確保を前提とした上で、消費者の誤認を招くものではなく、自主的かつ合理的な商品選択に資する制度としたいと考えております。本検討会では、今回から毎月1回程度の開催を予定しております。来年夏ごろを目途に報告書を取りまとめたいと考えております。
タイトなスケジュールですが、委員の皆様に忌憚のない意見を賜りますよう、お願いします。
○消費者庁山崎次長 なお、阿南長官は公務のため途中で退席させていただきます。
続いて、お手元の別紙に委員名簿がございます。
なお本検討会は、オブザーバーとして厚生労働省と農林水産省からも出席いただいています。
○消費者庁山崎次長 それでは、議事に入りますが、まず、当検討会の開催要領(案)について、担当から説明します。
○消費者庁竹田課長
それでは、資料1の開催要領について説明させていただきます。
「第1 趣旨」です。
先ほど長官の阿南からもありましたけれども、本年6月14日に規制改革実施計画、日本再興戦略という2つの閣議決定がございまして、いわゆる健康食品等の加工食品、農林水産物について、企業等の責任において科学的根拠をもとに機能性を表示する新しい制度を25年度中に開始し、26年度中に措置、実施をするということが決められてございます。
これらの閣議決定を受けまして、消費者庁長官のもとで本検討会を設置いたしまして、既存の特保制度、栄養機能食品制度、こちらがありますけれども、それとは別に、機能性の表示を企業等の責任においてできる新しい制度をつくるために議論を賜りたいと思っております。
「第2 検討項目」です。
1つには、まず安全性の確保が第一ですので、安全性確保の在り方。それから、機能性の表示をしていただくに当たって、どのような科学的根拠が必要なのかといった考え方。最後に、消費者が誤認することのない表示の在り方について検討いただきたい。
「第3 スケジュール及び今後の進め方」です。
まず、現行の機能性表示制度、特保、栄養機能表示、それから米国のダイエタリーサプリメント表示制度など、こうした国内外の現状等を踏まえつつ、関係者からの意見聴取、ヒアリングなども踏まえながら、平成26年、来年の夏を目途に報告書をお取りまとめいただきたい。
「第4 委員等」です。
これは先ほど紹介させていただいたとおりです。座長は、消費者庁長官から指名をさせていただきます。座長代理は、座長に指名をいただきます。
「第5 運営」です。
先ほど紹介がございましたように、厚生労働省、農林水産省、それから消費者庁ということで本制度をつくっていくということになってございますので、両省の協力を得て消費者庁で担当してまいります。
(2)で、委員以外の関係者に御出席をいただいて意見をいただくということについては、適宜、座長の判断で、随時行っていきたいと思っております。
1枚おめくりいただきまして、本検討会については、原則公開で行います。
(4)にありますように、資料については、消費者庁のホームページで公表いたします。
「ただし」、検討に著しい支障がある、その他、正当な理由があると座長が判断された場合には、一部について非公表とすることも可能としております。
なお、検討会の議事録につきましては、各委員の御確認を得た上で、消費者庁のホームページに公表することを予定してございます。
この要領に定めるもののほか、議事の手続、進め方等につきましては、座長に判断いただき、お決めいただくことにします。以上です。
○消費者庁山崎次長 それでは、この開催要領(案)で、当検討会の座長ですが、これは消費者庁長官が松澤先生にお願いしてございます。
それでは、松澤座長から挨拶をお願いします。
○松澤座長 座長を突然指名されて、大変戸惑っているというのが現状です。私の専門は、糖尿病とか脂質異常とか動脈硬化、生活習慣病を専門としておりますが、症例には食というのが極めて必要で、私自身は日本の和食文化、今度世界遺産にもなりましたが、非常にそれが優れていて、それをいかにバランスよく食べることによってメタボリックシンドロームを予防することに重点を置いておりますので、必ずしも機能性食品というのにはあまり今まで造詣がなかったわけですけれども、ただ、津々浦々まで浸透している日本人の健康志向は、何か健康にいい食べ物を摂取したいという意欲につながり、それに対応して、極めて荒唐無稽な広告とか、そういういろんなものがはびこっている中で、今回こういう機能表示をある程度しっかりした形で承認するという必要性はあると感じておりますので、そういうことに関して枠組みというか、明確にしていければと思っております。以上です。
○消費者庁山崎次長 ありがとうございました。
それでは、これから松澤座長で議事の進行をお願いします。
○松澤座長では、これから私の司会進行により議事を進めます。
まず、当検討会の運営におきまして、開催要領にありますとおり、座長代理をあらかじめ指名することになっております。座長代理につきまして、私から指名させていただきます。座長代理は、現在、消費者委員会の新開発食品評価調査会の座長、厚生労働省の食品衛生分科会新開発食品調査部会の座長をされておりまして、この分野に大変知見のある寺本委員にお願いしたいと思います。寺本委員は本日御欠席ですが、どうぞよろしくお願いいたします。
それでは、具体的な議題に入りたいと思います。
本日は本検討会の初回ですので、まずは「食品の機能性表示制度をめぐる事情」ということで、現行の食品の機能性表示制度、本検討会を開催する発端となった規制改革の経緯、米国などの食品の機能性表示制度などについて、事務局から説明をします。
○消費者庁塩澤調査官 それでは、資料の説明に移ります。
まずは資料2-1「現行の食品の機能性表示制度及び規制改革の経緯」、こちらの資料から説明します。
それでは、ページをおめくりいただきまして、目次について説明させていただきます。
ここでは初めに、現行の食品の機能性表示の概要と食品の機能性表示の歴史について説明いたします。次に、栄養機能食品制度と特定保健用食品の概要について、さらに、このたびの閣議決定の背景と内容につきまして順に説明をします。
3ページ目、まずは「現行の食品の機能性表示制度」です。
現行制度におきましては、機能性表示を行える食品は大きく2種類です。1つ目は、下の図の中央部分にございます特定保健用食品、いわゆる特保です。特保につきましては、その摂取により当該保健の目的が期待できる旨の表示ができるのです。
そして、もう一つは、下の図ですと、特保の左側にございます栄養機能食品です。
こちらにつきましては、栄養成分の機能の表示をすることができるというものです。この特定保健用食品と栄養機能食品を保健機能食品と呼んでおります。この保健機能食品以外の食品におきましては、保健の機能や栄養成分の機能の表示をすることができないというのが現行制度の概要です。
4ページ目、こちらは「食品の機能性表示制度の歴史」です。
まず、昭和59年から61年におきまして、国レベルで機能性の研究がなされました。その結果、「食品の3次機能」、例えば生体の生理機能の変調を修復する働き、すなわち体調調節機能などが提唱されまして、機能性食品の概念が生まれております。
その後、検討が進められまして、平成3年9月に特定保健用食品制度が施行されております。そして、平成5年6月になりますと、この特保の許可第1号が誕生しております。
そして、平成13年になりますと、栄養機能食品が制度化されまして、錠剤、カプセル等の形状が食品として認められるようになりました。さらには、平成21年9月になりますと、消費者庁、消費者委員会の発足ということで、保健機能食品制度を含む食品表示の制度が消費者庁に一元化されております。ちょうどこのころから、健康食品の表示に関する検討会というのがなされておりまして、平成22年の8月に論点整理がされてます。
また、平成25年1月、今年の1月には、消費者委員会から健康食品の表示等の在り方に関する建議というものが示されております。また、平成25年6月には食品表示法が公布されています。今年ですけれども、ちょうど消費者委員会の建議が示されたころから、規制改革会議におきまして食品の新たな機能性表示についての議論がされ始めまして、6月14日になりますと、新たな機能性表示をつくっていくと閣議決定されています。
5ページ目、まずは「栄養機能食品」の制度の概要を説明いたします。
栄養機能食品とは、食生活において特定の栄養成分の補給を目的として摂取するものに対し、当該栄養成分の機能の表示をするものです。この栄養機能食品として販売するためには、1日当たりの摂取目安量に含まれる当該栄養成分量が定められた上・下限値の範囲内になければなりません。また、この制度につきましては、後に述べます特保のように、個別の許可申請を行う必要はございません。自己認証制度です。
表示の規定につきましては、その下のところに例として示しております。わかりにくいかもしれませんが、赤の太字で示しているところが表示事項として決められているものです。
6ページ目に「栄養機能食品の表示例」を載せております。
栄養機能を表示するための基準が定められている成分は現在17種類でございまして、具体的にはビタミン12種類、ミネラル5種類です。一部ですが、栄養機能表示及び注意喚起表示の例を下に表として示してます。この栄養機能表示及び注意喚起表示につきましては、原則定型文として定められてますので、一字一句変えてはいけないというのが基本です。
では、7ページ「特定保健用食品」の説明をします。
特定保健用食品とは体調調節機能を有する成分、すなわち関与成分を含み、健康増進法第26条第1項の許可を受け、その摂取により、特定の保健の目的が期待できる旨の表示、すなわち、保健の用途の表示ができる食品です。
下の※印のところに保健の用途の表示ということで説明をさせていただいておりますが、例えば「おなかの調子を整える、コレステロールの吸収を抑える、食後の血中中性脂肪の上昇を穏やかにする」等の表示がございます。
平成25年12月12日現在ですが、1,091件の食品が特定保健用食品の許可等を受けております。また、このページの真ん中から下のあたりに表示例を載せております。また、太字になっているところが特定保健用食品としての義務表示事項です。
このページの下側のところに「条件付き特定保健用食品」という言葉が出てますけれども、こちらは、通常の特保に比べるとやや科学的根拠レベルは劣るものの、一定の科学的根拠があるというものについて認められるカテゴリーとして用意しております。
8ページ「特定保健用食品に表示できる保健の用途(例)」です。
この特定保健用食品では、個別の食品ごとにその保健の用途に係る科学的根拠が明らかであるかどうかなどを審査し、表示できる内容を許可しているものです。
ここでポイントになるのは、個別の食品ごとに評価がなされるところです。
そして、用途の例ということで下に表を載せておりますが、例えば「おなかの調子を整える」ですとか、血糖値に関するもの、血圧、コレステロールに関するものなどがございます。この表の下から2つ目を御覧いただきたいのですが、疾病リスク低減表示というものがございます。こちらにつきましては、ほかとはちょっと種類が異なりまして、疾病名を書いて、そのリスクが低減するという可能性について表示できるのでございまして、例えばそこに挙げております、「骨粗鬆症になるリスクを低減するかもしれません」という表示ができるスキームです。
9ページ、こちらは「特定保健用食品の表示許可手続」です。
消費者庁長官が特定保健用食品の表示許可をするに当たっては、その安全性及び効果について食品安全委員会及び消費者委員会の意見を聴くということになっております。また、薬事法による表示規制の抵触の有無につき厚生労働省の意見を聴くことになってます。
下に許可手続の流れを示しておりますが、原則、事業者からの申請が、自治体などを経由して消費者庁の食品表示企画課に上がってきます。
次に、消費者委員会に諮られます。ここでは、新開発食品評価調査会というところで主に効果、すなわち有効性の評価がなされます。
続いて、食品安全委員会に回され、ここで主に新規の関与成分の安全性を中心に審査がなされます。
次に、また消費者委員会にいきまして、今度は新開発食品調査部会で改めて安全性と効果の判断がなされます。
さらに、厚生労働省の医薬食品局にいきまして、ここでは医薬品の表示に抵触しないかどうかのチェックがなされるという流れになっております。
さらには、国立健康・栄養研究所または登録試験機関におきまして、関与成分量が本当にそのぐらいの量入っているのかという分析がなされます。そして、問題ないということになると晴れて消費者庁長官の許可が下りるという流れになっています。
この図の下に、例えば「食品健康影響評価を行うことが必要ではない特保」という矢印がございます。こちらについては、既に例えばAという成分で100ミリグラムというのが仮に決められていたとした場合、それよりも下回る量で何か申請が上がってきたという場合、改めて安全性評価を必要としないという場合に、このようなショートカットの手続があるというものです。
「規格基準型特保及び再許可等特保」という矢印もございますけれども、例えば再許可というのは味違い品など、そういった場合にはこのような流れで審査が行われる場合があるというものです。
10ページ目「特定保健用食品の審査に要する資料」という説明です。
この特定保健用食品の審査に当たりましては、有効性及び安全性の要件ごとに医学、栄養学に基づく根拠となる資料の提出を求めているというものです。ここでポイントになりますのは、有効性及び安全性につきまして、特保では最終製品を用いてヒト試験を行うことが必要という点です。
具体的には、下の図の真ん中に上段と下段の囲みがございますけれども、まず、上段のところ、これが「食品及び関与成分に係る保健の用途を医学的・栄養学に明らかにした資料」という説明ですが、真ん中あたりを見ていただきますと「ヒトを対象とした試験を実施し」という記載がございます。
有効性に関する試験については、その下ですが、「試験デザインについては、結果の客観性を確保する観点から、プラセボ食品摂取群を対照とした比較試験とする必要がある」というものになっております。
下の四角、安全性についてですが、こちらにおきましてもヒト試験が必要でして、過剰摂取試験、長期摂取試験、これが必要になってくるというものです。
右側の四角の上2つですけれども、この安全性ですとか有効性に関するような資料につきましては、「可能な限り最新の知見に基づいたものとし、医学・栄養学等の学術書、学術雑誌等に掲載された知見を含むものとする」ということになっております。
ヒト試験の被験者は、健常人から疾病の境界域のものに至るまでの範囲で目的とする保健の用途を対象として適切なものとするとなっておりまして、例えば下に例として示しておりますけれども、保健の用途ごとにデザインが推奨されておりまして、コレステロール関係、中性脂肪関係、体脂肪関係、血圧関係などで、こちらに示しているようなデザインというものを推奨しているというものです。
11ページ、こちらから規制改革会議の説明等の資料となります。
左側、現状ですけれども、先ほど申し上げたとおり、現行制度では機能性が可能なものは以下の2つでございまして、それ以外は機能性表示が不可となっております。
現行制度のイメージ図を中段に示しておりますが、この太く囲ったところ、すなわち栄養機能食品と特定保健用食品のみ機能性表示が可能というのが今の制度でして、いわゆる一般の食品、こちらについては機能性表示ができないというのが現行制度です。
こういった現状に対して、例えば栄養機能食品につきましては、対象成分が栄養成分に限定されているという指摘がございました。また、特定保健用食品につきましては、食品ごとに有効性や安全性に係るヒト試験が必須と先ほど申し上げましたけれども、このようなことになっておりますので、この許可手続に時間ですとか費用、そういったコストがかかるということで、特に中小事業者にあってはハードルが高くなっているという指摘がかねてよりございました。
このようなことに対して規制改革会議で議論がなされまして、規制改革会議におきましては、病気や介護を予防し、健康を維持して長生きしたいという国民のニーズがあること、また、我が国として世界に先駆けて健康長寿社会を実現したいという観点から今回の閣議決定がなされております。
すなわち、加工食品及び農林水産物について、企業等の責任で科学的根拠をもとに機能11
性を表示できる新たな方策を検討。今年度から検討を開始し、来年度、すなわち平成27年3月末までにそれを実施するということが示されております。
また、この検討に当たりましては、米国のダイエタリーサプリメントの表示制度を参考にすべきということ、また安全性の確保もしっかり考えていくということが、今年6月14日の閣議決定で示されております。
この制度が実現した場合のイメージ図を下に示しているのですけれども、新たに一般食品の一部が一定要件を満たせばという条件付きではございますが、事業者責任で機能性表示が可能になるというものです。まさに、この一定要件というものは、今後委員の皆様方に議論いただくところです。
12ページにおきましては、6月14日の閣議決定、こちらの文章を示しております。
具体的な説明は割愛させていただきます。
以上が現行制度、それから規制改革の経緯の説明です。
続きまして、資料2-2の説明に移らせていただきます。
こちらの資料につきましては、「米国等における食品の機能性表示制度」の説明です。
2ページ目の目次です。
この資料では、まず米国の健康強調表示制度がそもそもどうなっているかという説明を差し上げます。次に、ダイエタリーサプリメントの表示制度、そして、この制度について指摘されている問題点の例を紹介いたします。また、参考といたしまして、EUでは健康強調表示制度がどうなっているかという説明とコーデックスガイドラインにおいての健康強調表示の規定というものも紹介させていただきます。
3ページ目「米国の健康強調表示に関する制度」の説明です。
米国におきましては、表示の種類、大きく2つございます。
まず、1つ目が疾病リスク低減表示、そして構造機能表示、この2種類です。
疾病リスク低減表示につきましては、これは国、すなわち食品医薬品局(FDA)が管理しているものでございまして、事業者が自由にできるという制度ではございません。この制度、これも大きく2つ分かれまして、一つはヘルスクレーム、もう一つは条件付きヘルスクレームというものがございます。
上のヘルスクレームにつきましては、栄養成分、その他成分、特定の食生活、運動等と疾病リスク低減の関連性に関する表示でございまして、専門家の間に十分な科学的な合意、しっかりした科学的根拠があるということが条件になっております。
表示例といたしましてそちらに示しておりますけれども、「健康的な食事の一環として、適切なカルシウムとビタミンDを摂取すると同時に身体活動を行うことで、その後の人生における骨粗鬆症のリスクを低減することがあります」などが既に認められている表示としてございます。
次に、条件付きヘルスクレームですけれども、こちらの内容はほぼ上と似通っているのですが、ただ、ヘルスクレームよりも科学的根拠レベルが低いものとなっておりまして、科学的根拠レベルに応じて3段階の機能表示が設定されています。ここにはB、C、Dと概念としてありますけれども、3段階用意されております。
表示例として、例えば「セレンは前立腺がんのリスクを低下させる可能性があります。
本クレームに関する科学的根拠は決定的なものではありません。そのレビューに基づいてFDAはセレンが前立腺がんのリスクを低下させる可能性があることには同意していません」などのように条件付きの記載であるというのがこの制度の特徴です。
また、下ですけれども、構造機能表示は、まさにこれから説明の対象となるダイエタリーサプリメント制度です。こちらについては、国が一定のルールはつくってはおりますが、原則事業者の自己責任で表示が行える制度です。詳細は次のスライドで示します。
4ページ目、こちらが「ダイエタリーサプリメントの表示制度」の概要です。
実際に売られている製品の表示見本を例に概要説明をさせていただきます。
まず、赤で囲っております特徴①ですが、この制度では、事業者の自己責任で機能性の表示ができるものです。ただし、疾病リスク低減表示は禁止でして、疾病名を記載することは、一部例外はあるのですけれども、基本的には禁止です。もちろん、医薬品的な表示を書くことも当然禁止です。下に実際の表示例を示しております。
次に、特徴②ですが、この特徴①のような機能性表示を行う場合の規定ですけれども、国の評価を受けたものではない旨及び疾病の治療等を目的としたものではない旨の表示が必須となっておりまして、これは定型文として決められております。このような表示を行わなくてはいけないというのが特徴です。
また、特徴③に示してますが、ダイエタリーサプリメントにつきましては、形状の規定がありまして、例えば錠剤、カプセル、粉末、ソフトジェル、液体等のサプリメントのようなものに限定されております。
次に、販売後30日以内にFDAに製品情報を届出しないといけないとなっております。これにつきましては、特徴①に示しているような機能表示を行うという場合のみの規定です。
3番目に、新規成分に該当するようなものを使用したい場合には、これは事後ではなくて、販売の75日前までに企業がみずから安全性評価を所定のスキームにのっとって行い、それをFDAに届け出ないといけない規定になっております。
4番目ですが、有害事象発生時の連絡先の表示が必要という規定もありますし、有害事象発生時は、事業者からFDAに対して速やかに通告をしなくてはいけない規定もございます。有害事象情報はFDAなどのウェブサイトで公表されることになっております。そして、製品リコールに関する規定も用意されているというのがこの制度の概要です。
このようなダイエタリーサプリメント制度ですが、いろいろな問題点も指摘されておりまして、次の5ページですけれども、これはアメリカの政府内部からも指摘されている問題点の例として、一部ではございますが、示しております。
まず、第一に、有効性の実証に当たり考慮すべきとされている点が十分に考慮されていない可能性について示されています。こちらについては、保健福祉省監察総監室というところのレポートに示されているのですけれども、保健福祉省というのは、FDAの上位機関にあたるところでございまして、こちらが下の出典のところに示しておりますとおり、2012年にレポートを出しております。このレポートに示されている内容ですが、体重減少及び免疫機能に関する製品127品を対象に表示の適切性を調査した結果、事業者から提出されたヒト研究が557件ありまして、それについて調べたところ、有効性に関する表示内容の実証に重要と示されている4つの観点を全て考慮したと考えられるものは1つもなかったということが示されております。
この4つの観点というのは、有効性に関する事業者向けガイダンスというのがあるのですけれども、そちらに示されている観点でございまして、具体的には、表示の意味、表示とそのエビデンスとの関連性、エビデンスの質、そしてエビデンスの総合性、Totality of Evidenceという単語がありますけれども、こちら4点を考慮するのが重要というように示されております。
このTotality of Evidenceということについてはどんなものかといいますと、関連する研究を見る場合に、いいとこ取りするというのはよろしくありませんので、関連する論文などにつきまして肯定的、否定的内容を問わず、全て網羅的に収集して検討する。そして、総合的観点から肯定的と言えるのか、否定的で言えるのかを判断するというのがこのTotality of Evidenceの考え方です。
2つ目に挙げておりますけれども、事業者から提出されたこの557件のヒト研究のうち、否定的データであったのは4%にすぎなかった。先ほど申し上げたTotality of Evidenceという考え方のもと、肯定的であろうが、否定的であろうが、網羅的に収集するということをやれば、通常ですと否定的なのが4%しかないというのが考えにくいのではないかと。
もちろん、この4%が直ちにだめというわけではございませんが、通常では否定的が4%というのは考えにくいというものです。
また、この557件のうち、約半数である49%におきましては、当該製品の摂取が想定される集団ではない集団を対象とした研究でありまして、そもそも、これがエビデンスとして使えるのかどうか疑問である可能性が示されております。
6ページ、問題点その2ですが、不適正な表示により消費者の誤認を招く可能性も指摘されております。先の調査におきましては、7%の製品で記載が必須とされている免責表示、これは正しくはdisclaimerという英語で打ち消し表示という意味ですけれども、この打ち消し表示、免責表示が表示されていなかった実態がございます。
この免責表示というのは、先ほど示した下の括弧に記してある内容です。こういったものが7%の製品には記載されていなかった実態が挙げられてます。
また、20%の製品においては、本来、禁止されているはずの疾病に関する表示がなされていたということが挙げられております。
下の囲みのところですが、有害事象発生時の連絡先が表示されていなくて、健康被害の拡大防止が十分に図れない可能性も指摘されております。具体的には、20%の製品で有害事象発生時の連絡先が表示されていなかったというのが事実として挙げられてございます。
以上がダイエタリーサプリメント制度の説明です。
7ページ、ここからは参考情報ですけれども、初めにEUの健康強調表示に関する制度の説明をします。
EUにおきましては、表示の種類は大きく3つほどございまして、1つは構造機能表示、次に疾病リスク低減表示、また小児健康表示、この3種類がございます。ただ、許認可の主体におきましては、EC、EFSAなど示しておりますけれども、全て公的機関が管理していまして、アメリカのダイエタリーサプリメント制度のように事業者責任でできるものではございません。
構造機能表示におきましては、大きく分けると2種類ありまして、1つは13.1条クレーム、次に13.5条がありまして、13.1条は古典的な栄養素ですとか、一般的な成分が対象になるような制度です。表示例もそこに示しております。13.5条というのは、基本的には新規成分が対象になるような制度です。
次に、疾病リスク低減表示と小児健康表示につきましては、14条クレームというものがありまして適切な評価がなされるというものであり、表示例もそこに示しております。
8ページ、こちらはコーデックスガイドラインにおける健康強調表示の規定です。この健康強調表示の使用の国際ルールにつきましては、コーデックス食品表示部会というところで主に議論がなされまして、2004年に栄養及び健康強調表示の使用に関するガイドラインというのが採択されております。
このガイドラインを補完する健康強調表示の科学的実証に関する勧告というものがコーデックス栄養特殊用途食品部会というところで議論がなされまして、2009年に採択されているというものです。
なお、コーデックスというものは何かと申しますと、国連食糧農業機関、そして世界保健機関によって1962年に設立されたものでありまして、消費者の健康保護と公正な食品貿易の確保を目的とした組織です。現在、185の国とEUが参加して、もちろん我が国も参加しております。
下に、このガイドラインにおいてどのような健康強調表示の定義がなされているかなどを示してますが、ここでいうヘルスクレームとは、この下の3つ、すなわち栄養素機能強調表示、その他の機能強調表示、疾病リスク低減表示、これを全てまとめてコーデックスはヘルスクレームという具合に呼んでおります。
ここで1つ注意が必要なのは、コーデックスでは疾病リスク低減表示まで含めてヘルスクレームと呼んでいる点です。他方、先ほど申し上げたアメリカの制度におけるヘルスクレームとなりますと、疾病リスク低減表示のうち最も科学的根拠レベルは高いもの、それのみをヘルスクレームとしておりますので、アメリカで言うヘルスクレームとコーデックスで言うヘルスクレームは違うのだと承知いただければと思います。
次に、右側ですが、健康強調表示の科学的実証に関する勧告で、やや技術的なところが載っておりますけれども、重要な点を2点ほど紹介いたします。
上から3つ目ですが、入手可能なエビデンスの総合性を評価するというものが健康強調表示の実証プロセスとして挙げられております。このエビデンスの総合性というのは、まさに先ほど申し上げたTotality of Evidenceでありまして、コーデックスでもこの考え方が重視されているというのがまず特筆すべきところかなと思います。
次に、健康強調表示の実証の基準というところに、十分に設計されたヒト介入試験によって提供される根拠に基づくべきというのが挙げられております。
ここには示していないのですけれども、このコーデックスでは介入研究に基づくべきとなっていまして、ヒト観察研究のような介入ではないようなヒト試験、それのみをもってはエビデンスとしては不十分という記載もございます。
なお、ダイエタリーサプリメント制度におきましては、詳しくは今後、次回以降で説明いたしますけれども、どのようなエビデンスが必要かというところで、ガイダンスで示されていると、ヒト研究が必要とはなっているのですが、介入試験、そのうちダブルブラインドのRCTという非常に質が高いものがあるのですけれども、こちらについてゴールドスタンダードとなっております。ただし、アメリカでは観察研究のようなものについても適切に行われているのであれば差し支えないという規定になっているという点がコーデックスとアメリカで若干異なる点です。こちらについては先ほど申し上げたとおり、次回以降に詳しく述べます。
以上、駆け足で米国等における食品の機能性表示制度の説明をさせていただきました。
○松澤座長 どうもありがとうございました。
今後の検討に当たり、留意すべき点や検討の方向性などについては、資料3を説明いただいた後に、長めの意見交換の時間をとります。
まずは、ただいまの事務局からの説明を受けまして、現行制度などについて不明の点や質問がございましたら。どうぞ。
○大谷委員 最後に説明いただきましたコーデックスのガイドラインというのは、各国で検討するときにどのぐらいの拘束力があるものなのでしょうか。
○消費者庁塩澤調査官 コーデックスについては、強制力はございません。強制力はないのですけれども、各国とも正当な理由がない限り、それを参考にしていろいろな制度をつくることになっております。コーデックスが効力を生じるとすれば、例えばある国が正当な理由なくしてコーデックスの考え方よりも意図的に何か過度に厳しい規定を設けていた場合に、例えばほかの国と貿易上の問題が起きたという場合に、そのコーデックスのガイドラインなどに基づいているかどうかが非常に重要なものになってくると、そういった意味での効力はございます。
ただ、国際的な議論の末、いろんなガイドラインなどがつくられておりますので、各国ともコーデックスで示されているものは重視しているのが現状です。
○松澤座長 いかがでしょうか。どうぞ。
○津谷委員 同じく資料2-2のコーデックスのところですが、定義で「健康強調表示(Health claim)」とあります。ここは「Health claim」を日本語の「健康強調表示」に訳してあり、一方、その前にある米国のところではそのまま「ヘルスクレーム( Health Claims)」と片仮名で書いてあるのですが、意図的に使い分けているのでしょうか。
○松澤座長 いかがでしょうか。
○消費者庁塩澤調査官 意図的に書き分けております。先ほど申し上げたとおり、ややもすると、アメリカのヘルスクレームとコーデックスが言っているヘルスクレームは混同してしまう可能性もありますので、何らか書き分けが適切であろうと考えております。
○松澤座長 よろしいですか。
○津谷委員 もう一点。いずれ話が出てくるかと思うのですが、関連する領域で、通常の医薬品の場合にrisk reductionという用語は米国やEUで使われているのでしょうか。例えば日本では、アスピリンは心筋梗塞の再発を予防するとは添付文書には書いていなくて、血栓生成を抑制するような表現になっています。米国ではダイエタリーサプリメントのみがrisk reductionという言葉を使って、医薬品は使わないのでしょうか。回答は今日でなくてもよろしいです。
○消費者庁塩澤調査官 医薬品についてはわかりかねますので、調べます。
○松澤座長 いかがですか。
○厚生労働省赤川課長 医薬品につきまして、今、アスピリンの例が津谷委員から指摘がございましたけれども、いわゆる抗凝血作用につきましては、現在は表示といいますか、いわゆる薬事法上の承認の対象になっております効能または効果として認められておりますので、これは長い100年以上使用されているものですので、それまでに得られている科学的エビデンスをもとに、医学薬学上公知であるものとして承認された経緯がございます。これは、ここ十数年ぐらいの話です。
○松澤座長 では、津谷委員、どうぞ。
○津谷委員 以前、低用量アスピリンは小児用が出ていて、それを心筋梗塞の再発予防に適応外で使っていたのを1999年の2課長通知でもって適応を追加したということがありました。ただ、追加したときの適応の書きっぷりが、予防とかリスク低減とは書いていないですね。今おっしゃったような表現、具体的には忘れましたけれども。ですから、私の質問は、そういうリスク低減というような明確なコンセプトが医薬品で使われているかどうかなのです。
○松澤座長 よろしいでしょうか。どうぞ。
○清水委員 直接的な答えにならないかもしれないのですけれども、まず、prevention、予防は医薬品しか使えない、食品には使えないということで、risk reductionという言葉が食品に使っていい言葉として使われました。このようなpreventionに近い言葉として使われてきたのは、私の記憶ではEUのプロジェクトで「PASSCLAIM」というプロジェクトがあるのですが、その中で、食品に使用する言葉として公的に使われたと記憶しております。
preventionは医薬品のみに使え、食品には使えない。それに近い言葉としてrisk reductionという言葉を提案したということだと思います。
○松澤座長 どうぞ。
○津谷委員 細かいことで申しわけないのですが、日本ではpreventionに相当する予防という用語は医薬品においても使えない場合があるという話を聞いたことがあるのですが、後日でよろしいですので、お教えください。
○松澤座長 今後のこちらの進め方の中での話ですから、それで時間をとると問題ですけれども、私自身が座長をして、こんなプリミティブな質問をしていいかどうかという点はありますが、今回の検討は食品の機能性表示ですが、食品の定義があまり明確でなくて、今みたいに薬と共通の問題点のようなディスカッションになるというのは何となく違和感があるのですけれども、米国のものがサプリメントとかそういう話になっているのですけれども、基本的にはここで検討すべき食品の機能は、どういうイメージがあるものが出てくるのですか。やはりタブレットになってこういうものを薬ではないから食品として、それについての機能を論じるということですか。そうしたら、薬についての今のディスカッションがそうであるように、薬の評価とか安全性というと同一になるような感じがするのですけれども、そこのところをもう少し明確にしておいたほうがいいと思います。
○消費者庁塩澤調査官 今の答えですけれども、先ほどの説明でも差し上げましたが、このたび閣議決定で決められていることが何かと申しますと、加工食品、農林水産物となっておりまして、これは言ってみますと、全ての食品が対象になり得ます。
つまり、通常の食事に出てくるようなもの、例えば生鮮食品ですとか、普通の加工食品ですとか、あるいはいわゆるサプリメント形状をしているようなもの、こういったものにつきましても、医薬品ではない限り、食品であれば全て対象になり得るというのが今回の閣議決定の内容ですので、こういった食品についてどのようなルールを設けるべきかが皆様方に審議いただく内容です。
○松澤座長 サプリメントの中で、こういうタブレットも食品ですか。
○消費者庁塩澤調査官 そうです。
○松澤座長 わかりました。ほかに。
○合田委員 4ページ目のダイエタリーサプリメントの表示制度のところで教えていただきたいのですが、このような表示ができる場合に、エビデンスそのものと表示との関係というのか、その商品ではなくても米国は表示できる、その商品のものでなくてもエビデンスがあれば表示ができると、そのように考えてよろしいですか。それとも次のところの5ページ目の関係になると思いますけれども、4つの観点をうまく総合的に判断して、よければ表示ができると考えてよろしいですか。教えていただければと思います。
○消費者庁塩澤調査官 今の答えですが、結論を先に申し上げると、売ろうとしている最終商品でなくとも差し支えございません。こちらは後に有効性のところの議論をいただくときに、こちらから有効性の考え方がアメリカでどうなっているかは詳細には説明しますけれども、アメリカでは何をもって有効性と考えるかについての事業者向けのガイダンスが示されております。その中を見ますと、できれば最終製品を対象にエビデンスがあることが重要とはなっているのですが、それがないといけないという規定にはなっておりません。成分ベースとかでも説明がつくのであればエビデンスとして差し支えないという整理になっておりますので、特定保健用食品のように最終製品をもって評価したものでないものはだめという考え方になっていないのがアメリカの制度です。
○松澤座長 よろしいですか。どうぞ。
○合田委員 全く具体的になり過ぎるのかもしれないのですけれども、有効成分があって、実際にそのものが例えば錠剤、カプセルなどの場合には、そういうものが崩壊しない状態も当然出てきますよね。その辺のところの何かガイドラインとか、そういうレベルまで規定をされていますか。実際に成分のレベルというのは非常にやりやすいのですけれども、形状が食品であればまた別ですけれども、こういう錠剤とかカプセルの形状ですと、そこまで考えないと具体的に結果がつながらない可能性は高いと思います。
○消費者庁塩澤調査官 崩壊性とか、溶解性につきましては、今後、詳細に調べた上で、しかるべき議論のときにそういった情報提供もさせていただきます。
○松澤座長 今後、我々の規定の中でそういうことを検討していくということだと思います。どうぞ。
○赤松委員 今のところに関連しますが、ダイエタリーサプリメントの4つの観点がそろうと栄養成分として認められるぐらい厳しいのではないかと思います。アメリカでは、ヘルスクレームでのエビデンスとここに挙げられている4つの観点のエビデンスの差はどれぐらいあるのか教えていただけますか。
○消費者庁塩澤調査官 これも具体的な話になりますので、そういった議論をするときに詳しく示しておきますけれども、確かにアメリカではヘルスクレームに関するエビデンスの要件というガイダンスと、ダイエタリーサプリメントに特化したガイダンスを分けて設けられておりまして、そのヘルスクレームのほうのガイダンスについては、それこそRCTに関する詳細な説明とかそういったのが示されておりますので、そういう意味では、このダイエタリーサプリメントとヘルスクレームのほうのガイダンスの書き分けが若干なされています。具体的には、また今後の議論のときに示させていただきます。
○松澤座長 どうぞ。
○児玉委員 私も4ページ、5ページ、6ページ目ぐらいですか。アメリカで2012年にこれだけちゃんと守られていない食品が市場に出ていることが調査されたと思うのですけれども、そういうのは例えば野放しにすると、何か規制があってそういう商品はまたサプリメントの表示を剥奪するとか、何かそういう事後処置的なものはアメリカの制度にはあるのでしょうか。
○松澤座長 どうそ。
○消費者庁塩澤調査官 不適切なダイエタリーサプリメント製品があった場合は、もちろん、しかるべき措置などができることになっていまして、それも詳しくはまた後に紹介します。
○松澤座長 そういうことで、大体今諸外国、アメリカを中心とした事情がわかったことで、これについてどうするかという問題ではなくて、こういうのが今行われていて、これは十分な制度かどうか、このとおりやるというわけでは我々はないわけで、参考にしながら日本でしっかりとした今のディスカッションになった問題点をクリアしていきたいと思っております。
続きまして、検討会の今後の検討事項及び進め方について、事務局から説明をお願いします。
○消費者庁塩澤調査官 それでは、続きまして、資料3-1の説明をさせていただきます。
資料3-1は、「今後の検討事項等」の資料です。
目次にまず、この資料におきましては、新制度に向けての基本的な考え方を紹介して、さらに、今後この検討で想定される主な論点を紹介します。また、この食品の機能性表示に関する消費者意向等調査を現在行っているのですけれども、この概要についても説明しつつ、最後に、新たな機能性表示の実施に向けたスケジュールを紹介いたします。
それでは、3ページ目「新制度に向けての基本的な考え方」ということで、我々として新制度に向けてどのように考えているのかを図示化したものです。
まず、我々としては、一番上にあります安全性の確保、これが何といっても大前提と考えております。
また、左下に示しておりますが、機能性表示を行うに当たって必要な科学的根拠の設定もしっかり行っていく必要があると考えておりますし、右側、適正な表示という仕組みをしっかりつくりまして、消費者への情報提供が適切に行われることもきちんと考えていきたい。
この3点を十分考えていくことによりまして、中央部分に示しております消費者の誤認を招かない、自主的かつ合理的な商品選択に資する表示制度をつくっていきたいと考える次第です。
4ページ目、こちらは今後想定される主な論点です。
大きくは3点ほどありまして、1つ目は安全性の確保、次に機能性の表示、また、食品表示制度としての国の関与、この3点が大きな論点です。
「安全性の確保」については5点ほどありまして、1つ目は、対象となる食品、成分の範囲をどう考えるかという点。2つ目として、生産・製造及び品質の管理、これもどう図っていくかという点。また、3つ目に摂取量の在り方、これをどう考えていくのかも重要な論点と思っております。
4つ目に、健康被害等の情報収集、こちらも非常に大事になってまいりますし、また、5つ目の危険な商品の流通防止措置をどう講じていくかも重要かと思っております。
「機能性の表示」の論点ですけれども、1つ目は、企業等がみずから機能性を評価する際の科学的根拠レベルをどこに置くかという点も重要かと思っておりますし、あとは適切な機能性表示の範囲、つまり、どの程度までの書きぶりを機能性表示に認めるかという点も重要かと思います。消費者に誤解を与えないための情報の在り方、つまり表示の仕組み、表示の在り方をどう考えるかも重要と考えます。
「食品表示制度としての国の関与」ですけれども、1つ目は、安全性の確保、機能性の表示の適切性を担保するための仕組み、手続、これをどう考えるかというのも重要と思っておりますし、また、関係省庁の役割分担も重要になってくるかと思っております。
以上の大きく3点、これをしっかりと考えていくことによって、上と下の囲み、すなわち上のところは、国ではなく企業等がみずから科学的根拠を評価した上で、その旨及び機能を表示できる制度というもの、こういう制度と、下に挙げております消費者の誤認を招かない自主的かつ合理的な商品選択に資する制度、これが両立し得るものと考えております。
5ページ目、こちらは「食品の機能性表示に関する消費者意向等調査」の概要です。こちらの調査は、平成25年度、つまり、今年度の消費者庁調査事業で現在行われているもので、受託事業者は株式会社インテージリサーチです。
背景としては、先般の閣議決定で新たな機能性表示制度をつくることが示されたのですが、先ほども述べましたとおり、参考にすべきとされているアメリカの制度には、種々の問題点も指摘されてますので、その種々の問題点を検討し、それを何とかクリアしていく知見を得ていきたいのがこの調査の主眼です。
真ん中の目的は、消費者の誤認を招かず、消費者の自主的かつ合理的な商品選択に資するような機能性表示制度を検討するための基礎資料を得ることを目的に、大きく2つ、今回は取り組んでおります。「① 米国ダイエタリーサプリメント制度に関する課題等整理」。そして「② 機能性表示に関する消費者の読み取りに関する実態調査」の二本柱です。
下の概要ですが、まず1つ目、課題等整理のところですけれども、米国のダイエタリーサプリメント制度については、我々としては、現在、英語の原文に当たるなどして制度の把握に努めておりますけれども、こちらについてもきちんと関連の法令とか指針とか、レポート、論文などを収集して適切に和訳しておく必要があるだろうと、和訳をやっております。
また、この和訳の結果などをもとに、有効性、安全性表示方法等の観点から、新たな表示制度の検討に当たり、留意すべき点を図とか表などを用いることもあわせまして、わかりやすく整理していくことがここでの取組です。
続きまして、「② 機能性表示に対する消費者の読み取りに関する実態調査」です。
この誤認を防ぐ制度の在り方に関する知見を得ることを目的に、今回は機能性表示に対する誤認率が高いと想定される集団、具体的には高齢者、病者、疾病予備軍も含めまして、こういった方々や、妊婦さんですとか妊娠計画中の人、そして乳幼児の保護者ですとか未成年者等を対象にグループヒアリングを実施してまいります。
具体的には、アメリカの製品を和訳した見本などをテーブルの上に広げるなどして、こういった機能性表示に関する誤認率が高いであろうと思われる人たちに、このアメリカのような食品が出てきた場合に、どういう点で誤認が生じ得るのか。逆にいいますと、どうすればこういった方々でも誤認しないのかという点を丁寧に探っていきたいと考えております。
こちらの結果を踏まえて、次の○に書いておりますけれども、インターネット調査を行っていきたいと考えております。先ほどのグループヒアリングにつきましては、やはり人数の制約というものもございますので、このインターネット調査、3,000人ぐらいの規模で行うということによって、グループヒアリングで得られた知見の数的な担保を図っていきたいと考えております。
以上の結果を踏まえて、私どもとしては、具体的な制度案、たたき台案をつくりまして、この検討会の場においてそれを示して、皆様方にいろいろな立場、いろいろな観点から議論いただき、制度につなげていきたいと考えております。
次のスライドに移りますが、具体的な制度の実施に向けたスケジュールを示しております。上の四角のところ「本検討会での議論」が、まさにこの検討会のスケジュール案でして、前半は安全性の確保に関する検討を主に行ってまいりたいと考えております。そして、後半以降においては、先ほど申し上げた消費者意向等調査、それをもとにしたたたき台案をこちらに示して、機能性の評価、また表示の在り方などについて議論いただきたいと考えております。
何とか来年の夏ぐらいまでにこの議論を取りまとめまして、その後「法令等改正」となっておりますけれども、消費者委員会に意見を聴取したり、パブリック・コメントという形で国民の皆様方に広く意見を聴取することを行って制度を固めまして、その後、広く周知期間というのを設けまして、何とか平成26年度末までに新たな制度を始めたいと考えております。
続きまして、資料3-2「今後の進め方(案)」です。
第1回目は今回ですけれども、背景説明、それから今後について、そういった内容で行いたいと思っております。
2回目以降から各論の話に入ってまいりまして、第2回、第3回、第4回ぐらいで安全性の確保について議論賜りたいと考えております。
そして、第4回目の途中ぐらいから第6回目ぐらいまでに機能性の評価及び表示の在り方についての検討などをしていただきまして、第6回目では国の関与の在り方なども議論いただきたいと考えております。
そして、第7回、第8回と大体2回ぐらいでこの検討会としての取りまとめを行っていただき、何とかこの議論を固めていきたいと思っております。
以上が資料3-2の説明です。
Posted by 第1回 食品の新たな機能性表示制度に関する検討会(1/2) at 2014年03月17日 10:41
○松澤座長 それでは、今の説明をもとに検討会の今後の検討事項及び進め方について、皆さんから今の資料などをもとに質問いただければと思います。梅垣委員、どうぞ。
○梅垣委員 資料3-1の3ページですけれども、この図を見て、表示は結局誰のための表示の制度かというと、今のところ、何か企業のための表示のようになっているのですね。消費者がきっちり表示を読めるようなことをしなければいけないというのが非常に重要だと思うのですけれども、それが見えません。
アメリカのダイエタリーサプリメントの説明をされていましたけれども、あれはeducationというのが入っているのですね。だから、表示をする上では必ず教育が連動していなければ消費者は読めませんから、その点を1つ考慮しなければいけないということです。また、いろんな国の表示があるのですけれども、これは国の、例えば健康政策とか栄養政策に合っていないと方向性は見えないということがありますけれども、その点をどう考えているかを質問したいのです。
○松澤座長 いかがですか。消費者庁。
○消費者庁竹田課長 言葉足らずでございましたけれども、基本的には、消費者が表示の情報を参考に自主的に商品を選択していくということですので、そこのピンクのところにありますように、我々はそこのところを重視して消費者庁として制度の構築をしてまいりたいと思っております。指摘のように、表示の意味するところをきちんと読み解くという点では先生おっしゃるとおり、私たちの消費者行政というのは大変大事になってまいりますので、重要な指摘です。
かつ、健康栄養政策の部分ですけれども、これは外れてしまいますけれども、政府としては基本的には、日本型食生活ということで三度の御飯を食べていただいて、ほどよい運動をして、よく眠って健康になるのが大前提で、そこを推奨していくということですので、その上で個々の方々、消費者が何か足りないというときにこういう商品を選ばれるときには、間違いのないような情報の読み解きができるような、そういうラベリングにしていきたいと考えて制度の検討に当たっていきたいと思っております。
○松澤座長 よろしいですか。赤松委員、どうぞ。
○赤松委員 今の梅垣先生の意見に付け加える意見になりますが、この制度をヘルスプロモーションの観点から考えると、やはり評価が必要だと思います。この制度を実施したら、その目的とする食品選択に役立ったかということを見なければいけない。そのためにここに書かれている誤認を招かないというのはとても曖昧な言葉であり、評価が難しいのではないかと思っています。さらに、全ての消費者が誤認を招かないという目標を達成するためには、制度だけでは無理であり、梅垣先生がおっしゃったように教育もあわせてやらないと、この目標達成は難しいと思います。今、論点の中に消費者に対することが入っていないので、今回は取り上げない予定かもしれないのですけれども、少し検討いただければと思います。
○松澤座長 そういうことを含めてこれから我々のところで進めていく内容になってくると思います。
○消費者庁竹田課長 もちろん指摘の点を踏まえていかなければいけないと思っていまして、大変申しわけないのですけれども、4ページで論点ということで提示させていただいた部分は、仮に制度にすると書き切るときにはこういう要素を書き切るということで提示をさせていただいたものでして、当然、消費者庁の行政として、その周りにたくさんあるわけですので、先生のおっしゃるようなことも当然これからさらに取り組んでいかなければいけないと思っております。
○松澤座長 宮島委員、どうぞ。
○宮島委員 日本通信販売協会の宮島です。
我々の協会は、加盟が約500社、賛助会員が200社、計700社強ですけれども、主に通信販売をチャネルとして販売している業界です。扱っているのは食品だったり化粧品だったりするわけですけれども、そこのスタンスでいきますと、この国の生活者のより豊かな暮らしのために一体我々は何ができるかというのは基本ではありますけれども、こういう検討会に出させていただいたときに、ややも欠落するのは、お客様の声という視点が足りないと思っています。今回は調査も入りますので、ぜひお客様の声を先ほど表示のところもあったのですけれども、お客様の立場でわかる表示、誤認を与えない表示とするのが一番大事だと思っていまして、決して企業のためにやるわけではないので、わかりやすい表示、誤認をしない表示、1962年にケネディさんの言った消費者の4つの権利はまさしくそれだと思うのですけれども、そういう立場で進めていきたいと思っています。以上です。
○松澤座長 森田委員、どうぞ。
○森田委員 消費者の立場から意見をさせていただきます。
今回、梅垣先生がお話しされましたように、この制度、規制改革会議のお話が出まして、全国消団連でも勉強会をして梅垣先生にも来ていただいて、消費者団体が大変懸念しているとお話しました。今、既に栄養機能食品と特保があり、その上に今回一定の要件を満たした新しいものが出てくると。今までは機能性ということがうたえなくて、機能性をにおわせるような、そういう表示がされていたものがたくさんあったわけです。それが今回、再来年の3月でいきなり新しい製品ジャンルとして出てくると、市場が整理されるのか。むしろ、混乱をするのではないか。今まで表示で機能性をうたえなかったものが、いきなり機能性がうたえるようになると、この制度を知らない消費者からすると、何か製品が変わったのではないかとか、特別なものになったのではないかとか、そう誤認をしてしまうことがあります。今回進め方において、機能性の評価がまともにやるのが何回かしかなくて表示の機能性評価を一定の要件をエビデンスで、ということで話し合われるようになって、表示の在り方をどう考えに入れていくのか。例えばFDAのように打ち消し表示があっても、今とても問題があるわけですから、打ち消し表示をどのぐらい大きくするのか。今まである既存の制度と違って、新しいジャンルの製品のものをどういう表示をしていくのか。それによって消費者がどう誤認するのか。十分にそこは時間をとってやっていただかなくてはいけない。
あともう一つは、合田先生が先ほどおっしゃっていた品質の問題が安全性のところに入っておりますけれども、これは機能性の評価の部分にもかなり関連してくるところです。そこの部分もどういう情報を出していくのか。ラベルの表示の在り方もあるのですけれども、アメリカの情報発信の中では、例えばその成分においていろんな論文がいいものも悪いものも全部トータルに読めるようになっていて、そういうものが消費者教育において大事ということですけれども、そういう情報もこの制度ができるまでにきちんと整えておかないと、やはり市場が混乱します。 消費者教育とか情報発信、国からの情報発信という部分も並行してここで検討していっていただかないと混乱することになるので、そこについても、どこか第4回とか第5回のところで消費者に対してどういった情報発信や消費者教育が必要か、ちゃんとそこのところをセーフティネットみたいにしてもらわないといけないと思います。そこの議論のところを加えていただきたい。第3回とか第4回とか早い段階で加えていただきたいと思います。
○消費者庁竹田課長 その点については、すみません、資料にはなかなかにじみ出てはいなかったのですけれども、我々もそういう問題があるというのは認識していますので、座長と相談をした上で、適宜議題として議論いただけるように努力します。
○松澤座長 何となく薬の開発みたいな、それに近いようになるので安全性というのが非常に表に出ています。基本的には食品といったら、安全性というものをチェックする必要性はあるのかどうか、むしろ、その食品の機能について言っていることが本当に科学的かどうか、そちらのほうが本来重要で、現状非常に誇大広告的なものであっても、ものが出ているのは、食品の場合はよほど特別なものでない限りはあまり危ないものはないと思いますが、逆にいえば効かないということになるかと思います。
大体薬物というのは効くから副作用があるわけで、だから、安全性がどうのこうのという食品など論外だということはあるのですけれども、ただ、やはり消費者庁としては安全確保というのはかなり重要なので、まず、本当に事例としてどういうのがあるのかとか、そういうのは挙げていただいてそれについて論じていく必要もあるかなと思います。そういうもののカテゴリーがあれば安全性上極めて重要視する。
例えばイソフラボンというものも非常にいいのでとか、大豆からのものと言われて、ただ、それをたくさん摂り過ぎると女性ホルモンがどうの、何かに影響すると、そういうのが論文として出たりするのですけれども、実際には大豆たんぱくをいくらとって何かになるというのはそんなにないので、食品というのはそういうものではあるのですけれども、だから食という今回我々が対象にするもの、カテゴリーというのが薬ではないというところの中で、薬に近いものがこの中に入ってくるかどうかですね。どうぞ。
○森田委員 そこが、薬ではないからと思って健康食品を利用する人たちの中に健康危害が今出てきているわけです。そういう危害事例がいろんなところで報告されるけれども、それがなかなか梅垣先生のところのサイトを見ても消費者に届かなかったりします。あと今回、アメリカの機能性表示の制度の説明で、保健福祉省の監査室の報告書がありましたけれども、ここで機能性の問題、有効性の問題が主に今回紹介されましたけれども、たしか安全性の危害はかなり紹介されていたと記憶しているのです。
アメリカでは、やはり薬ではないからということでいくつものいろんなものを安易に試して複合作用が起きたりとか、むしろそこで問題が起こっているところをとても消費者団体は懸念しているわけです。
○松澤座長 だから、安全性というのを最初にしっかりやっていこうということだと思います。先生は、むしろ機能のことを言われたので私はそう言っているだけであって、基本的には、これは消費者に対してのしっかりしたメッセージなので、やはり安全性から確保するという、そういう流れになっていると理解していただきたい。ほかに何か。どうぞ。
○相良委員 月刊「食生活」という雑誌をつくっています相良と申します。
私たちは、主に生産者の方を取材しているのですけれども、でも今回、制度の概要を見て、農林水産物とか、生産者にかかわる点がちょっと気になるのです。
例えば今、実際に取材先でも、うちのピーマンはすごくビタミンCが多いから取材してくれとか、リコピンが多いからうちのトマトを食べたほうがいいよとか、具体的にそれを取材してくれという依頼なども増えているのですが、その場合に、例えばそういったもので農産物の差別化を図っていくことになるのかもしれないのですけれども、その場合に、農家の方がそれに対してどのぐらい知識を持てるのかとか、では、うちはビタミンCを多くしないと売れないのではないかと思ってしまうのではないかとか、そういったことを最近感じるので、先ほど教育というお話がありましたけれども、知識をどうやってそういう方たちに広めていくのかが疑問というか、心配という点なのです。
○松澤座長 竹田さん、どうぞ。
○消費者庁竹田課長 農林水産物につきましては、通常、生産者の方個人というのが大多数だと思われますので、これはまだ制度の設計の話になりますけれども、基本的には農家の方を束ねるJAであったり、あるいは大谷先生の研究されている機関ですとか、農林水産省の技術部門ですとか、そうしたところが今回の機能性のことについて農家の方々をサポートする役割を担っていくのだろうと、それで制度運営をされていくと思っています。
その上で、もしそういう制度に乗っかってくるような産地、品種、銘柄みたいなものが例えば出てまいりますれば、通常のいわゆる営農指導のような形で、JAはその組織として農家さんを現場で束ねていく形でお取組み、営農いただくイメージなのかなと。これはまだ全然制度がどんな形になるかでき上がっていませんのであくまでイメージですけれども、そうした形で特に農家の方は企業とは違いますので、そうした束ね方、まとめ方があろうかと思います。
○松澤座長 よろしいでしょうか。大谷委員、どうぞ。
○大谷委員 多分、この中で農林水産物は私と相良先生が担当かもしれません。今、個々の農家の方がビタミンCなどに注目している話がありましたが、これから表示の問題を考えていく場合には、やはり大らかな気持ちで、ビタミンCが入っていますよ、うちでは多いですよというのは通じません。ある程度どこかで測定をするなりバラツキを見ることが必要になってきます。その上で、今、課長がおっしゃった何らかのシステムで、きちんと多くの方にそれを伝えないと、そもそも表示のシステム自体が崩れてしまいます。そこは気をつけて運営するよう農水省が考えると思います。
農産物の成分品質は、栽培条件だとか、取る摘採時期によってある程度はコントロールできますけれども、基本的に、少しばらつきがあり、あるいは成分値が少し変動がございますので、そのあたりはしっかり担保する必要があります。もちろん、機能性の効果にも変動はありますが、これもいくつか研究結果が出ておりますので、そういうものをモデルにして検討してはどうかと思います。ただ、安全性に関しては、どちらかというと、農林水産物ですと一遍に100個も食べられませんから、問題になることは少ないと思います。ここで議論いただくときには、最初座長がおっしゃったように、食品の定義というのがサプリメントから生鮮食品までと非常に広いので、これのどこを議論しているかというのを少しずつ皆さんの頭で整理しながら議論いただけたらと思います。
○松澤座長 今後、そういう形でカテゴリー別でやらないと全然違う議論になってしまうので、そういうことを含めて、ある程度ここに係る食というものを分けておいたほうがいいかもわからないですね。そこらあたりをよろしくお願いしたいと思う。最初のスタートは薬になってしまう。だから、そこらあたりも含めて今後検討したいと思います。梅垣先生、どうぞ。
○梅垣委員 安全性確保の面で、今、皆さん恐らく考えられているのは製品の問題です。それは合田先生が先ほどおっしゃった製品面を考慮されています。けれども、もう一つ問題があって、まともな製品でも、例えば病気の治療に使ったりする利用方法の問題もあります。健康食品の多くの問題は、病気が治るというイメージで皆さんとっているのです。だから、製品に問題がなくても、そういう使い方の問題が出てくると、消費者はまともな医療にアクセスできなくなってしまうのです。この点だけはきっちり対応できるようにしないと、いろんな表示をするとかなり問題になってきます。ですから、医療費ももっとかかるようになってくるのではないかなと思うのです。安全性の確保というのは、使い方という面を入れていかないとだめはないかと思います。
○松澤座長 アメリカもそういうところに少しはケアフルになって、そういう添付みたいなのはあるのですね。先ほどお話のあったように、疾病とかにはエビデンスとして出していないと。
○梅垣委員 そうですね。だから、消費者庁が海外の機能表示を調査されていましたけれども、韓国とか中国とかEUとか、病気が治るとか治療できるという表示はどこの国も一切認めていないのですね。だから、その点を絶対に守らなければいろんな問題を起こす原因になると思います。
○松澤座長 そういう表示の問題は、ぜひ最終的なところまでの間に明確にしていただきたいと思います。宮島委員、どうぞ。
○宮島委員 資料2-1の4ページに「食品の機能性表示制度の歴史」とあるのですけれども、私の知る限り、食品の機能性を理論化したのは日本が最も一番進んでいたと思っています。ただ、制度化に落とし込むところが遅れている気がしまして、今回はそこをきちっとやっていかなければいけないと思っています。
例えばサプリメントにしても、先ほど梅垣先生がおっしゃったのですけれども、食事にとってかわるものと思うのではなくて、やはりきちっと三度の食事をとって、それで足りないものを補うという考え方を表示しなくてはいけない。現在ほとんどの商品は表示していると思いますけれども、そういうのも入れるとか、やはり通常の食品からサプリメントまで含めてきちっとカテゴライズしておかないと表示が混乱すると思うのですね。それはぜひお願いしたい。以上です。
○松澤座長 どうもありがとうございました。どうぞ。
○児玉委員 私も健康食品にあまり詳しくはないのですが、例えば今薬局とかスーパーに行きますと、サプリメント的なのが山のように売られています。ここでこういう制度ができて、それでちゃんと規制するのはいいのですが、それ以外で今いろんな表示で過大評価、広告しているようなものもあると思うのですけれども、そういうのは何か一応取締りは常にされているのでしょうか。そちらのほうがすごく気になります。
○松澤座長 竹田課長、どうぞ。
○消費者庁竹田課長 具体的には、先般も報道された事例がございましたけれども、1つには、消費者庁の職員自身がウェブなどで適宜怪しい情報を探す。それから、消費者の皆様から怪しい、疑義情報といいますけれども、そうしたものを頂戴する。そういうものを受けまして、具体的には景品表示法という法律がございますけれども、商品を何か実体よりもよいものだと、先生がおっしゃるような広告のようなものをうって誤解をさせて販売をするものについては消費者庁として取締りをしてございますので、これは今後ともしっかり取り組んでまいりたいと思っております。
○松澤座長 よろしいでしょうか。
その機能性表示ができると、さらにそれを厳格にというか、明確にやれると、そうなるのでしょうか。
○消費者庁山崎次長 今回の議論なのですけれども、見方によるのですが、ある面、今まで表示の禁止を解除するという意味でいけば規制緩和でもあるのですが、確かにおっしゃるとおり、実は世の中にいっぱい本当かなという表示の現状も確かにあります。逆に言いますと、それをちゃんと一方で適正化していく話もあった上でのまさに我々議論だと思ってます。
したがって、確かにこの場面というのは制度との議論ですけれども、一方で、本当の意味の取締りというとおかしいですが、ちょうどメニュー表示で大変問題になっているのですけれども、それ以外だって当然表示はあるわけですね。今回、これはメニュー表示から来ていますけれども、実はいろんな監視指導体制を相当強化しようと思っていまして、この関係でいけば都道府県のほうにもいろんな措置命令権を与えたり、消費者庁はまだ小さな役所なもので、いろんなところでやっていただくという形で強化しようと思っていますので、それが当然前提だと考えていただきたいと思います。
○児玉委員 ぜひ検討いただきたいと思います。
○松澤座長 ほかにございますか。どうぞ。
○合田委員 今の意見につけ加えさせていただきますと、やはり実効がある罰則規定であるかどうかが非常に大きく影響するのだと思うのです。ぜひこういうポジティブなものを認めていく際には、逆にそうでないことをすることに関しては、実効性のある罰則規定が裏にあって初めて認めていくことになるのだろうと思いますので、ぜひそこまで踏み込んで考えていただければと思います。この会でそこまで議論するのかどうか私はわかりませんけれども、そうしないと、実は消費者に誤認させる表示まで平気で出てくるような形になると思うので、よろしくお願いします。
○松澤座長 では、山崎次長、どうぞ。
○消費者庁山崎次長 この制度自体のペナルティと言ったらおかしいですが、しっかり守っていただく仕組みとあわせて、先ほどの景品表示法、まさに不当表示全般にわたりますが、当然健康食品関係も当たりますけれども、要するに、やり得のような状況がございますので、今ちょうどこちらから消費者委員会に課徴金制度といったようなものができないかを諮問、検討をお願いしています。これも検討を急いだ上で、必要であれば、これは法律になりますけれども、そういう形のものを当然議論していきます。
○松澤座長 ありがとうございます。
我々の検討会で罰則がどうのというのよりも、むしろ建設的にしっかりとした明確な科学的な根拠に基づいた表示をどうやって、やっていただくか、そういうことがこの検討会のミッションだと思いますので、ぜひそういうつもりで、そういうことをやる食品とそれ以外は明確に分かれるのだというぐらいのつもりでやっていきたいと思っております。
まだ時間がありますが、いかがですか。どうぞ。
○森田委員 今の広告、そちらのほうでは景品表示法で厳しく取締まるというお話がありましたけれども、今回の新しい制度をどこに落とし込むかをお聞きしたいのです。
4ページには、食品表示制度としての国の関与とありまして、これは今回新しく例えば安全性ですとか品質とか機能性とか、そういう一定の要件を設けて、一般食品のところから図のように特保の横にある黄色い部分のものの1つジャンルをつくるときに、その表示は食品表示法の中の何らかの基準、そこで設けるというイメージなのでしょうか。
○消費者庁竹田課長 具体的な制度設計は全くこれからの話ですので確定的ではございませんけれども、基本的には先生おっしゃいましたように、一定の何らかの要件を備えたものについては、こういう表示まではできるようにする仕組みをつくることですので、その表示をするという意味では、表示の制度にはなると。トートロジーですけれども、そういうことになろうかと思います。そこにルールをつくって一定の表示を認めていくということです。ただ、仕立ての仕方、たてつけの仕方は、これから先生方に議論いただいた上で我々のほうで事務的に検討していきたい。
○松澤座長 森田委員、どうぞ。
○森田委員 ということを聞きましたのは、その新しいルールを決めるときに、景品表示法であればそちらの執行体制がそれぞれあると思うのですが、食品表示法の中でそれを決めるとすれば、執行体制は食品表示法でやるところの執行ということになるわけでしょうか。すなわち、地方自治体における食品表示法を担うところ、保健所だったり、そういうところになるのでしょうか。
○消費者庁竹田課長 先ほど次長から説明申し上げましたけれども、景品表示法というのは食品の表示に限らず、あらゆるものをカバーしてございますので、そういう意味では食品の表示と重なる部分がございます。食品の表示として不適切なものが景品表示法上の表示としても不適切なものになるといった関係は当然出てまいりますので、そういう意味では、この制度について、例えばどちらか一方の規制を受けることにはならないと思っております。この表示としての制約ルールは守っていただきますし、景品表示法上の表示としてのルールも守っていただく、そういう形になろうかと思います。すみません、抽象的で申しわけないです。
○松澤座長 よろしいですか。そのほかございますか。これからの進め方という、今そういうことをベースに検討しているのですが、どうぞ。
○津谷委員 今後の進め方で、資料3-2には、次回から安全性3回、その次の機能性の評価が2回ということです。私はもともと臨床薬理学という分野の出身ですが、どうも機能性という言葉は違和感があって、基本的には有効性の話だと思うのですね。
資料3-1に事務局でつくられた「新制度に向けての基本的な考え方」として3つの輪っかを含む図があります。安全性の確保、機能表示を行うに当たって必要な科学的根拠の設定、適正な表示による消費者への情報提供。この3つをベースとして「消費者の誤認を招かない、自主的かつ合理的な商品選択に資する表示制度」を検討する、これは大変よくできたわかりやすい図だと思います。そこでの「科学的根拠」が、6月14日の閣議決定で使われた言葉なのですね。「企業等の責任において科学的根拠のもとに機能性を表示できるあらたな方策・・・」とあります。
一方、先ほどのアメリカ、ヨーロッパに関する資料は、みんな片仮名でエビデンスと書いてあって、日本だけ科学的根拠です。私は、安全性のエビデンス、有効性のエビデンス、経済性、すなわち費用対効果のエビデンス、とどうしても言ってしまうのですが、日本のことを話すには、今後この会では常に科学的根拠と言わないといけないものでしょうか。
どうしても私はエビデンスという言葉を使ってしまうのですが。
○松澤座長 用語上の問題ですが、竹田課長、お願いします。
○消費者庁竹田課長 基本的には、私どもの業界はなるべく漢字、平仮名で書くというのが原則になっていまして、横文字、仮名片表記はできるだけ避けるということで多分こういう文案になっているので、むしろ、こちらの皆様の業界ではエビデンスというのが普通に用いられているとお聞きしておりますので、そういう形で発言いただいて全く問題ないと思います。
○松澤座長 先生おっしゃるように、機能性という言葉自体も、よい機能、悪い機能とありますから、同じものでも悪いほうにいくことだってあるわけで、コレステロールだっていいほうと悪いほうとある。牛乳もコレステロールが高い人には悪くなるけれども、骨粗鬆症の人にはいいのだとか、それは非常に微妙だと思うのですけれども、ここにある機能はいいほうの機能というイメージで用語として使っているという意味ですから、安全性に対応するものだと、ここでは最初から機能性食品とか食品機能という言葉で閣議決定でスタートしていますので、我々としてはそういうことを頭の中では十分理解した上で進めていくことになる。
ほかに何かございますか。梅垣先生、どうぞ。
○梅垣委員 1つ、調べるというか検討していただきたいのは、特保と栄養機能食品の制度を維持しつつと書いてありますけれども、今、このハードルの低いような制度をもしつくったとしたら、現行の特保とか栄養機能食品をやっているメーカーは、恐らく離れていくと私は思うのですね。特保の制度は20年ぐらいたってかなり検討されています。まだ問題点もありますけれども、それが全く無駄になってしまうような気がするのです。その点を実際に企業なりに調査されたほうがいいと私は思います。
それに関連して、資料2-1の7ページに条件付き特定保健用食品というのがあるのですが、これは、根拠は必ずしも確立していませんが、何とかの可能性があると、結局、今回こういう表示をしようということですね。今、この条件付き特保は、恐らく1つか2つか、それぐらいしかないと思うのです。だから、なぜ企業側がこういう条件付き特保をとらないかというのも一応調査というか、調べてみる必要はあるのではないかなと思います。
○松澤座長 これについて竹田さん、いかがでしょうか。
○消費者庁竹田課長 指摘を踏まえて、事務的に検討させていただきたいと思います。
○松澤座長 ほかに意見ございますか。
今後は、アンケートか何か調査が行われるわけです。並行してやっていると。その安全性に関しても、基本的に、どういう安全性を論じるのかという何か具体例がないと、漠然とした安全性と言っても薬の安全性とは違う部分がありますので、いくつかのカテゴリーというか、今の食品でどういうことが問題なのかをちょっと調べていただいて、そういうものについてどうチェックしていくかと、そういうことをやらないとなかなか薬の安全性とは違う部分をしっかり我々も勉強していかないとだめだと、そう思っております。どうぞ。
○合田委員 先ほど座長が今後の進め方の中で、形態等についてカテゴリー別のことを考えなければいけないと、まさにそのとおりだと思うのですが、もう一つ、考えておかなければいけない分け方に、対象物がはっきりしているものと、全体、食品などの場合、天然物の場合にはいろんなエビデンスはあるけれども、実際にはどれが明確に影響しているか、効いているかわからない場合もありますから、そういう分け方も1つカテゴリーの中に、そういう切り口も入れていただいて議論を進めていただければと思います。
○松澤座長 そういう対象というのも本当に漠然とした健康志向と、何かその人の病気のサポートみたいなものも入ってくるわけですよね。骨粗鬆症などだと大概そういう話があるので、割合、普通の健康食品はそういうことが物すごくうたわれていることがありますし、そういうことも含めて整理しながらやらないと、全部が数的に表示というのは、ルールは基本としても、どういうやり方でするかは変わる可能性がありますね。対象の食品。
ほかに今後の進め方で意見ございますか。どうぞ。
○合田委員 今の話に付け加えますと、先ほどの梅垣先生が言われた、昔の条件付き特保の議論のときにあった議論が2つありまして、1つはエビデンスのレベルが低いものもこれは入ってしまっているのですけれども、エビデンスのレベルが低いものよりも、エビデンスがどれに由来しているかわからないものも、ここに実は含めて議論はされていたという経緯はあるのですね。今回もエビデンスにおいて成分そのものを特定できなくても、こういう食品を摂ればこういうことがいいよということがわかるということも多分対象になると思います。そういう意味で、はっきりエビデンスの対象物がわかっているならコントロールしやすいですけれども、そうではないものは別の考え方をしないといけないと思いますので、それをどこかの議論の中に入れていただければと思っております。
○松澤座長 そういう扱いはここで一番難しくなってくる。だから、そういうものをどう扱うかが最終的に今表示を推進することにならないのか、なるのかになってくると思いますが、いずれにしても、いろんな方向性が大体出てきましたが、ほかに付け加えること、今後の進め方について意見はございませんか。
○津谷委員 今、合田先生が発言されたことの補足ですが、スライド7の特定保健用食品の下の条件付き特定保健用食品の表示例で「○○を含んでおり、根拠は必ずしも確立されていませんが・・・」と、この○○を含んでいるというのが、これは合田先生が専門ですけれども、リーディングコンパウンドが含まれているわけですね。1つか2つぐらいは必ずわかると思うのですが、それが決してアクティブかどうかはわからない。そういったものを含んでグロスというか、まとめた上での話が別のカテゴリーではないかと、そういう話ですね。
○合田委員 エビデンスは必ず何か言う際には、そこに関連して品質管理をどうするかという問題が常に横につながりますので、そういうグロスで見るものに対してどのように品質管理されているかとか、常にパラレルだろうと思います。
○松澤座長 医薬品の場合は品質管理というか、何かその成分が正しく入っているかというのは、やっているわけね。
○消費者庁塩澤調査官 はい。やっております。
○松澤座長 今回は、今後の検討ですけれども、そういうところはどう扱うか。
それも非常に重要な観点です。
そういうことで一個一個勉強していかないといけないプロジェクトだと思いますが、大体方向性がわかりましたし、最初どういう目的かと懐疑的だったのですが、こういうことをきちっとやっていくことは非常に重要だとみんなで共通理解されたものと思っております。
それでは、今日の検討されたスケジュール案に沿って、今後、検討項目の検討を進めていきたいと思っております。具体的な検討課題は、本日の議論を踏まえて決定しまして、後日、連絡させていただきます。本日、これで閉会します。
事務局から連絡事項お願いします。
○消費者庁竹田課長 次回の会合は、年明けの1月31日、午前9時半からを予定しています。本日はありがとうございました。
http://www.caa.go.jp/foods/pdf/gijiroku_1.pdf
○梅垣委員 資料3-1の3ページですけれども、この図を見て、表示は結局誰のための表示の制度かというと、今のところ、何か企業のための表示のようになっているのですね。消費者がきっちり表示を読めるようなことをしなければいけないというのが非常に重要だと思うのですけれども、それが見えません。
アメリカのダイエタリーサプリメントの説明をされていましたけれども、あれはeducationというのが入っているのですね。だから、表示をする上では必ず教育が連動していなければ消費者は読めませんから、その点を1つ考慮しなければいけないということです。また、いろんな国の表示があるのですけれども、これは国の、例えば健康政策とか栄養政策に合っていないと方向性は見えないということがありますけれども、その点をどう考えているかを質問したいのです。
○松澤座長 いかがですか。消費者庁。
○消費者庁竹田課長 言葉足らずでございましたけれども、基本的には、消費者が表示の情報を参考に自主的に商品を選択していくということですので、そこのピンクのところにありますように、我々はそこのところを重視して消費者庁として制度の構築をしてまいりたいと思っております。指摘のように、表示の意味するところをきちんと読み解くという点では先生おっしゃるとおり、私たちの消費者行政というのは大変大事になってまいりますので、重要な指摘です。
かつ、健康栄養政策の部分ですけれども、これは外れてしまいますけれども、政府としては基本的には、日本型食生活ということで三度の御飯を食べていただいて、ほどよい運動をして、よく眠って健康になるのが大前提で、そこを推奨していくということですので、その上で個々の方々、消費者が何か足りないというときにこういう商品を選ばれるときには、間違いのないような情報の読み解きができるような、そういうラベリングにしていきたいと考えて制度の検討に当たっていきたいと思っております。
○松澤座長 よろしいですか。赤松委員、どうぞ。
○赤松委員 今の梅垣先生の意見に付け加える意見になりますが、この制度をヘルスプロモーションの観点から考えると、やはり評価が必要だと思います。この制度を実施したら、その目的とする食品選択に役立ったかということを見なければいけない。そのためにここに書かれている誤認を招かないというのはとても曖昧な言葉であり、評価が難しいのではないかと思っています。さらに、全ての消費者が誤認を招かないという目標を達成するためには、制度だけでは無理であり、梅垣先生がおっしゃったように教育もあわせてやらないと、この目標達成は難しいと思います。今、論点の中に消費者に対することが入っていないので、今回は取り上げない予定かもしれないのですけれども、少し検討いただければと思います。
○松澤座長 そういうことを含めてこれから我々のところで進めていく内容になってくると思います。
○消費者庁竹田課長 もちろん指摘の点を踏まえていかなければいけないと思っていまして、大変申しわけないのですけれども、4ページで論点ということで提示させていただいた部分は、仮に制度にすると書き切るときにはこういう要素を書き切るということで提示をさせていただいたものでして、当然、消費者庁の行政として、その周りにたくさんあるわけですので、先生のおっしゃるようなことも当然これからさらに取り組んでいかなければいけないと思っております。
○松澤座長 宮島委員、どうぞ。
○宮島委員 日本通信販売協会の宮島です。
我々の協会は、加盟が約500社、賛助会員が200社、計700社強ですけれども、主に通信販売をチャネルとして販売している業界です。扱っているのは食品だったり化粧品だったりするわけですけれども、そこのスタンスでいきますと、この国の生活者のより豊かな暮らしのために一体我々は何ができるかというのは基本ではありますけれども、こういう検討会に出させていただいたときに、ややも欠落するのは、お客様の声という視点が足りないと思っています。今回は調査も入りますので、ぜひお客様の声を先ほど表示のところもあったのですけれども、お客様の立場でわかる表示、誤認を与えない表示とするのが一番大事だと思っていまして、決して企業のためにやるわけではないので、わかりやすい表示、誤認をしない表示、1962年にケネディさんの言った消費者の4つの権利はまさしくそれだと思うのですけれども、そういう立場で進めていきたいと思っています。以上です。
○松澤座長 森田委員、どうぞ。
○森田委員 消費者の立場から意見をさせていただきます。
今回、梅垣先生がお話しされましたように、この制度、規制改革会議のお話が出まして、全国消団連でも勉強会をして梅垣先生にも来ていただいて、消費者団体が大変懸念しているとお話しました。今、既に栄養機能食品と特保があり、その上に今回一定の要件を満たした新しいものが出てくると。今までは機能性ということがうたえなくて、機能性をにおわせるような、そういう表示がされていたものがたくさんあったわけです。それが今回、再来年の3月でいきなり新しい製品ジャンルとして出てくると、市場が整理されるのか。むしろ、混乱をするのではないか。今まで表示で機能性をうたえなかったものが、いきなり機能性がうたえるようになると、この制度を知らない消費者からすると、何か製品が変わったのではないかとか、特別なものになったのではないかとか、そう誤認をしてしまうことがあります。今回進め方において、機能性の評価がまともにやるのが何回かしかなくて表示の機能性評価を一定の要件をエビデンスで、ということで話し合われるようになって、表示の在り方をどう考えに入れていくのか。例えばFDAのように打ち消し表示があっても、今とても問題があるわけですから、打ち消し表示をどのぐらい大きくするのか。今まである既存の制度と違って、新しいジャンルの製品のものをどういう表示をしていくのか。それによって消費者がどう誤認するのか。十分にそこは時間をとってやっていただかなくてはいけない。
あともう一つは、合田先生が先ほどおっしゃっていた品質の問題が安全性のところに入っておりますけれども、これは機能性の評価の部分にもかなり関連してくるところです。そこの部分もどういう情報を出していくのか。ラベルの表示の在り方もあるのですけれども、アメリカの情報発信の中では、例えばその成分においていろんな論文がいいものも悪いものも全部トータルに読めるようになっていて、そういうものが消費者教育において大事ということですけれども、そういう情報もこの制度ができるまでにきちんと整えておかないと、やはり市場が混乱します。 消費者教育とか情報発信、国からの情報発信という部分も並行してここで検討していっていただかないと混乱することになるので、そこについても、どこか第4回とか第5回のところで消費者に対してどういった情報発信や消費者教育が必要か、ちゃんとそこのところをセーフティネットみたいにしてもらわないといけないと思います。そこの議論のところを加えていただきたい。第3回とか第4回とか早い段階で加えていただきたいと思います。
○消費者庁竹田課長 その点については、すみません、資料にはなかなかにじみ出てはいなかったのですけれども、我々もそういう問題があるというのは認識していますので、座長と相談をした上で、適宜議題として議論いただけるように努力します。
○松澤座長 何となく薬の開発みたいな、それに近いようになるので安全性というのが非常に表に出ています。基本的には食品といったら、安全性というものをチェックする必要性はあるのかどうか、むしろ、その食品の機能について言っていることが本当に科学的かどうか、そちらのほうが本来重要で、現状非常に誇大広告的なものであっても、ものが出ているのは、食品の場合はよほど特別なものでない限りはあまり危ないものはないと思いますが、逆にいえば効かないということになるかと思います。
大体薬物というのは効くから副作用があるわけで、だから、安全性がどうのこうのという食品など論外だということはあるのですけれども、ただ、やはり消費者庁としては安全確保というのはかなり重要なので、まず、本当に事例としてどういうのがあるのかとか、そういうのは挙げていただいてそれについて論じていく必要もあるかなと思います。そういうもののカテゴリーがあれば安全性上極めて重要視する。
例えばイソフラボンというものも非常にいいのでとか、大豆からのものと言われて、ただ、それをたくさん摂り過ぎると女性ホルモンがどうの、何かに影響すると、そういうのが論文として出たりするのですけれども、実際には大豆たんぱくをいくらとって何かになるというのはそんなにないので、食品というのはそういうものではあるのですけれども、だから食という今回我々が対象にするもの、カテゴリーというのが薬ではないというところの中で、薬に近いものがこの中に入ってくるかどうかですね。どうぞ。
○森田委員 そこが、薬ではないからと思って健康食品を利用する人たちの中に健康危害が今出てきているわけです。そういう危害事例がいろんなところで報告されるけれども、それがなかなか梅垣先生のところのサイトを見ても消費者に届かなかったりします。あと今回、アメリカの機能性表示の制度の説明で、保健福祉省の監査室の報告書がありましたけれども、ここで機能性の問題、有効性の問題が主に今回紹介されましたけれども、たしか安全性の危害はかなり紹介されていたと記憶しているのです。
アメリカでは、やはり薬ではないからということでいくつものいろんなものを安易に試して複合作用が起きたりとか、むしろそこで問題が起こっているところをとても消費者団体は懸念しているわけです。
○松澤座長 だから、安全性というのを最初にしっかりやっていこうということだと思います。先生は、むしろ機能のことを言われたので私はそう言っているだけであって、基本的には、これは消費者に対してのしっかりしたメッセージなので、やはり安全性から確保するという、そういう流れになっていると理解していただきたい。ほかに何か。どうぞ。
○相良委員 月刊「食生活」という雑誌をつくっています相良と申します。
私たちは、主に生産者の方を取材しているのですけれども、でも今回、制度の概要を見て、農林水産物とか、生産者にかかわる点がちょっと気になるのです。
例えば今、実際に取材先でも、うちのピーマンはすごくビタミンCが多いから取材してくれとか、リコピンが多いからうちのトマトを食べたほうがいいよとか、具体的にそれを取材してくれという依頼なども増えているのですが、その場合に、例えばそういったもので農産物の差別化を図っていくことになるのかもしれないのですけれども、その場合に、農家の方がそれに対してどのぐらい知識を持てるのかとか、では、うちはビタミンCを多くしないと売れないのではないかと思ってしまうのではないかとか、そういったことを最近感じるので、先ほど教育というお話がありましたけれども、知識をどうやってそういう方たちに広めていくのかが疑問というか、心配という点なのです。
○松澤座長 竹田さん、どうぞ。
○消費者庁竹田課長 農林水産物につきましては、通常、生産者の方個人というのが大多数だと思われますので、これはまだ制度の設計の話になりますけれども、基本的には農家の方を束ねるJAであったり、あるいは大谷先生の研究されている機関ですとか、農林水産省の技術部門ですとか、そうしたところが今回の機能性のことについて農家の方々をサポートする役割を担っていくのだろうと、それで制度運営をされていくと思っています。
その上で、もしそういう制度に乗っかってくるような産地、品種、銘柄みたいなものが例えば出てまいりますれば、通常のいわゆる営農指導のような形で、JAはその組織として農家さんを現場で束ねていく形でお取組み、営農いただくイメージなのかなと。これはまだ全然制度がどんな形になるかでき上がっていませんのであくまでイメージですけれども、そうした形で特に農家の方は企業とは違いますので、そうした束ね方、まとめ方があろうかと思います。
○松澤座長 よろしいでしょうか。大谷委員、どうぞ。
○大谷委員 多分、この中で農林水産物は私と相良先生が担当かもしれません。今、個々の農家の方がビタミンCなどに注目している話がありましたが、これから表示の問題を考えていく場合には、やはり大らかな気持ちで、ビタミンCが入っていますよ、うちでは多いですよというのは通じません。ある程度どこかで測定をするなりバラツキを見ることが必要になってきます。その上で、今、課長がおっしゃった何らかのシステムで、きちんと多くの方にそれを伝えないと、そもそも表示のシステム自体が崩れてしまいます。そこは気をつけて運営するよう農水省が考えると思います。
農産物の成分品質は、栽培条件だとか、取る摘採時期によってある程度はコントロールできますけれども、基本的に、少しばらつきがあり、あるいは成分値が少し変動がございますので、そのあたりはしっかり担保する必要があります。もちろん、機能性の効果にも変動はありますが、これもいくつか研究結果が出ておりますので、そういうものをモデルにして検討してはどうかと思います。ただ、安全性に関しては、どちらかというと、農林水産物ですと一遍に100個も食べられませんから、問題になることは少ないと思います。ここで議論いただくときには、最初座長がおっしゃったように、食品の定義というのがサプリメントから生鮮食品までと非常に広いので、これのどこを議論しているかというのを少しずつ皆さんの頭で整理しながら議論いただけたらと思います。
○松澤座長 今後、そういう形でカテゴリー別でやらないと全然違う議論になってしまうので、そういうことを含めて、ある程度ここに係る食というものを分けておいたほうがいいかもわからないですね。そこらあたりをよろしくお願いしたいと思う。最初のスタートは薬になってしまう。だから、そこらあたりも含めて今後検討したいと思います。梅垣先生、どうぞ。
○梅垣委員 安全性確保の面で、今、皆さん恐らく考えられているのは製品の問題です。それは合田先生が先ほどおっしゃった製品面を考慮されています。けれども、もう一つ問題があって、まともな製品でも、例えば病気の治療に使ったりする利用方法の問題もあります。健康食品の多くの問題は、病気が治るというイメージで皆さんとっているのです。だから、製品に問題がなくても、そういう使い方の問題が出てくると、消費者はまともな医療にアクセスできなくなってしまうのです。この点だけはきっちり対応できるようにしないと、いろんな表示をするとかなり問題になってきます。ですから、医療費ももっとかかるようになってくるのではないかなと思うのです。安全性の確保というのは、使い方という面を入れていかないとだめはないかと思います。
○松澤座長 アメリカもそういうところに少しはケアフルになって、そういう添付みたいなのはあるのですね。先ほどお話のあったように、疾病とかにはエビデンスとして出していないと。
○梅垣委員 そうですね。だから、消費者庁が海外の機能表示を調査されていましたけれども、韓国とか中国とかEUとか、病気が治るとか治療できるという表示はどこの国も一切認めていないのですね。だから、その点を絶対に守らなければいろんな問題を起こす原因になると思います。
○松澤座長 そういう表示の問題は、ぜひ最終的なところまでの間に明確にしていただきたいと思います。宮島委員、どうぞ。
○宮島委員 資料2-1の4ページに「食品の機能性表示制度の歴史」とあるのですけれども、私の知る限り、食品の機能性を理論化したのは日本が最も一番進んでいたと思っています。ただ、制度化に落とし込むところが遅れている気がしまして、今回はそこをきちっとやっていかなければいけないと思っています。
例えばサプリメントにしても、先ほど梅垣先生がおっしゃったのですけれども、食事にとってかわるものと思うのではなくて、やはりきちっと三度の食事をとって、それで足りないものを補うという考え方を表示しなくてはいけない。現在ほとんどの商品は表示していると思いますけれども、そういうのも入れるとか、やはり通常の食品からサプリメントまで含めてきちっとカテゴライズしておかないと表示が混乱すると思うのですね。それはぜひお願いしたい。以上です。
○松澤座長 どうもありがとうございました。どうぞ。
○児玉委員 私も健康食品にあまり詳しくはないのですが、例えば今薬局とかスーパーに行きますと、サプリメント的なのが山のように売られています。ここでこういう制度ができて、それでちゃんと規制するのはいいのですが、それ以外で今いろんな表示で過大評価、広告しているようなものもあると思うのですけれども、そういうのは何か一応取締りは常にされているのでしょうか。そちらのほうがすごく気になります。
○松澤座長 竹田課長、どうぞ。
○消費者庁竹田課長 具体的には、先般も報道された事例がございましたけれども、1つには、消費者庁の職員自身がウェブなどで適宜怪しい情報を探す。それから、消費者の皆様から怪しい、疑義情報といいますけれども、そうしたものを頂戴する。そういうものを受けまして、具体的には景品表示法という法律がございますけれども、商品を何か実体よりもよいものだと、先生がおっしゃるような広告のようなものをうって誤解をさせて販売をするものについては消費者庁として取締りをしてございますので、これは今後ともしっかり取り組んでまいりたいと思っております。
○松澤座長 よろしいでしょうか。
その機能性表示ができると、さらにそれを厳格にというか、明確にやれると、そうなるのでしょうか。
○消費者庁山崎次長 今回の議論なのですけれども、見方によるのですが、ある面、今まで表示の禁止を解除するという意味でいけば規制緩和でもあるのですが、確かにおっしゃるとおり、実は世の中にいっぱい本当かなという表示の現状も確かにあります。逆に言いますと、それをちゃんと一方で適正化していく話もあった上でのまさに我々議論だと思ってます。
したがって、確かにこの場面というのは制度との議論ですけれども、一方で、本当の意味の取締りというとおかしいですが、ちょうどメニュー表示で大変問題になっているのですけれども、それ以外だって当然表示はあるわけですね。今回、これはメニュー表示から来ていますけれども、実はいろんな監視指導体制を相当強化しようと思っていまして、この関係でいけば都道府県のほうにもいろんな措置命令権を与えたり、消費者庁はまだ小さな役所なもので、いろんなところでやっていただくという形で強化しようと思っていますので、それが当然前提だと考えていただきたいと思います。
○児玉委員 ぜひ検討いただきたいと思います。
○松澤座長 ほかにございますか。どうぞ。
○合田委員 今の意見につけ加えさせていただきますと、やはり実効がある罰則規定であるかどうかが非常に大きく影響するのだと思うのです。ぜひこういうポジティブなものを認めていく際には、逆にそうでないことをすることに関しては、実効性のある罰則規定が裏にあって初めて認めていくことになるのだろうと思いますので、ぜひそこまで踏み込んで考えていただければと思います。この会でそこまで議論するのかどうか私はわかりませんけれども、そうしないと、実は消費者に誤認させる表示まで平気で出てくるような形になると思うので、よろしくお願いします。
○松澤座長 では、山崎次長、どうぞ。
○消費者庁山崎次長 この制度自体のペナルティと言ったらおかしいですが、しっかり守っていただく仕組みとあわせて、先ほどの景品表示法、まさに不当表示全般にわたりますが、当然健康食品関係も当たりますけれども、要するに、やり得のような状況がございますので、今ちょうどこちらから消費者委員会に課徴金制度といったようなものができないかを諮問、検討をお願いしています。これも検討を急いだ上で、必要であれば、これは法律になりますけれども、そういう形のものを当然議論していきます。
○松澤座長 ありがとうございます。
我々の検討会で罰則がどうのというのよりも、むしろ建設的にしっかりとした明確な科学的な根拠に基づいた表示をどうやって、やっていただくか、そういうことがこの検討会のミッションだと思いますので、ぜひそういうつもりで、そういうことをやる食品とそれ以外は明確に分かれるのだというぐらいのつもりでやっていきたいと思っております。
まだ時間がありますが、いかがですか。どうぞ。
○森田委員 今の広告、そちらのほうでは景品表示法で厳しく取締まるというお話がありましたけれども、今回の新しい制度をどこに落とし込むかをお聞きしたいのです。
4ページには、食品表示制度としての国の関与とありまして、これは今回新しく例えば安全性ですとか品質とか機能性とか、そういう一定の要件を設けて、一般食品のところから図のように特保の横にある黄色い部分のものの1つジャンルをつくるときに、その表示は食品表示法の中の何らかの基準、そこで設けるというイメージなのでしょうか。
○消費者庁竹田課長 具体的な制度設計は全くこれからの話ですので確定的ではございませんけれども、基本的には先生おっしゃいましたように、一定の何らかの要件を備えたものについては、こういう表示まではできるようにする仕組みをつくることですので、その表示をするという意味では、表示の制度にはなると。トートロジーですけれども、そういうことになろうかと思います。そこにルールをつくって一定の表示を認めていくということです。ただ、仕立ての仕方、たてつけの仕方は、これから先生方に議論いただいた上で我々のほうで事務的に検討していきたい。
○松澤座長 森田委員、どうぞ。
○森田委員 ということを聞きましたのは、その新しいルールを決めるときに、景品表示法であればそちらの執行体制がそれぞれあると思うのですが、食品表示法の中でそれを決めるとすれば、執行体制は食品表示法でやるところの執行ということになるわけでしょうか。すなわち、地方自治体における食品表示法を担うところ、保健所だったり、そういうところになるのでしょうか。
○消費者庁竹田課長 先ほど次長から説明申し上げましたけれども、景品表示法というのは食品の表示に限らず、あらゆるものをカバーしてございますので、そういう意味では食品の表示と重なる部分がございます。食品の表示として不適切なものが景品表示法上の表示としても不適切なものになるといった関係は当然出てまいりますので、そういう意味では、この制度について、例えばどちらか一方の規制を受けることにはならないと思っております。この表示としての制約ルールは守っていただきますし、景品表示法上の表示としてのルールも守っていただく、そういう形になろうかと思います。すみません、抽象的で申しわけないです。
○松澤座長 よろしいですか。そのほかございますか。これからの進め方という、今そういうことをベースに検討しているのですが、どうぞ。
○津谷委員 今後の進め方で、資料3-2には、次回から安全性3回、その次の機能性の評価が2回ということです。私はもともと臨床薬理学という分野の出身ですが、どうも機能性という言葉は違和感があって、基本的には有効性の話だと思うのですね。
資料3-1に事務局でつくられた「新制度に向けての基本的な考え方」として3つの輪っかを含む図があります。安全性の確保、機能表示を行うに当たって必要な科学的根拠の設定、適正な表示による消費者への情報提供。この3つをベースとして「消費者の誤認を招かない、自主的かつ合理的な商品選択に資する表示制度」を検討する、これは大変よくできたわかりやすい図だと思います。そこでの「科学的根拠」が、6月14日の閣議決定で使われた言葉なのですね。「企業等の責任において科学的根拠のもとに機能性を表示できるあらたな方策・・・」とあります。
一方、先ほどのアメリカ、ヨーロッパに関する資料は、みんな片仮名でエビデンスと書いてあって、日本だけ科学的根拠です。私は、安全性のエビデンス、有効性のエビデンス、経済性、すなわち費用対効果のエビデンス、とどうしても言ってしまうのですが、日本のことを話すには、今後この会では常に科学的根拠と言わないといけないものでしょうか。
どうしても私はエビデンスという言葉を使ってしまうのですが。
○松澤座長 用語上の問題ですが、竹田課長、お願いします。
○消費者庁竹田課長 基本的には、私どもの業界はなるべく漢字、平仮名で書くというのが原則になっていまして、横文字、仮名片表記はできるだけ避けるということで多分こういう文案になっているので、むしろ、こちらの皆様の業界ではエビデンスというのが普通に用いられているとお聞きしておりますので、そういう形で発言いただいて全く問題ないと思います。
○松澤座長 先生おっしゃるように、機能性という言葉自体も、よい機能、悪い機能とありますから、同じものでも悪いほうにいくことだってあるわけで、コレステロールだっていいほうと悪いほうとある。牛乳もコレステロールが高い人には悪くなるけれども、骨粗鬆症の人にはいいのだとか、それは非常に微妙だと思うのですけれども、ここにある機能はいいほうの機能というイメージで用語として使っているという意味ですから、安全性に対応するものだと、ここでは最初から機能性食品とか食品機能という言葉で閣議決定でスタートしていますので、我々としてはそういうことを頭の中では十分理解した上で進めていくことになる。
ほかに何かございますか。梅垣先生、どうぞ。
○梅垣委員 1つ、調べるというか検討していただきたいのは、特保と栄養機能食品の制度を維持しつつと書いてありますけれども、今、このハードルの低いような制度をもしつくったとしたら、現行の特保とか栄養機能食品をやっているメーカーは、恐らく離れていくと私は思うのですね。特保の制度は20年ぐらいたってかなり検討されています。まだ問題点もありますけれども、それが全く無駄になってしまうような気がするのです。その点を実際に企業なりに調査されたほうがいいと私は思います。
それに関連して、資料2-1の7ページに条件付き特定保健用食品というのがあるのですが、これは、根拠は必ずしも確立していませんが、何とかの可能性があると、結局、今回こういう表示をしようということですね。今、この条件付き特保は、恐らく1つか2つか、それぐらいしかないと思うのです。だから、なぜ企業側がこういう条件付き特保をとらないかというのも一応調査というか、調べてみる必要はあるのではないかなと思います。
○松澤座長 これについて竹田さん、いかがでしょうか。
○消費者庁竹田課長 指摘を踏まえて、事務的に検討させていただきたいと思います。
○松澤座長 ほかに意見ございますか。
今後は、アンケートか何か調査が行われるわけです。並行してやっていると。その安全性に関しても、基本的に、どういう安全性を論じるのかという何か具体例がないと、漠然とした安全性と言っても薬の安全性とは違う部分がありますので、いくつかのカテゴリーというか、今の食品でどういうことが問題なのかをちょっと調べていただいて、そういうものについてどうチェックしていくかと、そういうことをやらないとなかなか薬の安全性とは違う部分をしっかり我々も勉強していかないとだめだと、そう思っております。どうぞ。
○合田委員 先ほど座長が今後の進め方の中で、形態等についてカテゴリー別のことを考えなければいけないと、まさにそのとおりだと思うのですが、もう一つ、考えておかなければいけない分け方に、対象物がはっきりしているものと、全体、食品などの場合、天然物の場合にはいろんなエビデンスはあるけれども、実際にはどれが明確に影響しているか、効いているかわからない場合もありますから、そういう分け方も1つカテゴリーの中に、そういう切り口も入れていただいて議論を進めていただければと思います。
○松澤座長 そういう対象というのも本当に漠然とした健康志向と、何かその人の病気のサポートみたいなものも入ってくるわけですよね。骨粗鬆症などだと大概そういう話があるので、割合、普通の健康食品はそういうことが物すごくうたわれていることがありますし、そういうことも含めて整理しながらやらないと、全部が数的に表示というのは、ルールは基本としても、どういうやり方でするかは変わる可能性がありますね。対象の食品。
ほかに今後の進め方で意見ございますか。どうぞ。
○合田委員 今の話に付け加えますと、先ほどの梅垣先生が言われた、昔の条件付き特保の議論のときにあった議論が2つありまして、1つはエビデンスのレベルが低いものもこれは入ってしまっているのですけれども、エビデンスのレベルが低いものよりも、エビデンスがどれに由来しているかわからないものも、ここに実は含めて議論はされていたという経緯はあるのですね。今回もエビデンスにおいて成分そのものを特定できなくても、こういう食品を摂ればこういうことがいいよということがわかるということも多分対象になると思います。そういう意味で、はっきりエビデンスの対象物がわかっているならコントロールしやすいですけれども、そうではないものは別の考え方をしないといけないと思いますので、それをどこかの議論の中に入れていただければと思っております。
○松澤座長 そういう扱いはここで一番難しくなってくる。だから、そういうものをどう扱うかが最終的に今表示を推進することにならないのか、なるのかになってくると思いますが、いずれにしても、いろんな方向性が大体出てきましたが、ほかに付け加えること、今後の進め方について意見はございませんか。
○津谷委員 今、合田先生が発言されたことの補足ですが、スライド7の特定保健用食品の下の条件付き特定保健用食品の表示例で「○○を含んでおり、根拠は必ずしも確立されていませんが・・・」と、この○○を含んでいるというのが、これは合田先生が専門ですけれども、リーディングコンパウンドが含まれているわけですね。1つか2つぐらいは必ずわかると思うのですが、それが決してアクティブかどうかはわからない。そういったものを含んでグロスというか、まとめた上での話が別のカテゴリーではないかと、そういう話ですね。
○合田委員 エビデンスは必ず何か言う際には、そこに関連して品質管理をどうするかという問題が常に横につながりますので、そういうグロスで見るものに対してどのように品質管理されているかとか、常にパラレルだろうと思います。
○松澤座長 医薬品の場合は品質管理というか、何かその成分が正しく入っているかというのは、やっているわけね。
○消費者庁塩澤調査官 はい。やっております。
○松澤座長 今回は、今後の検討ですけれども、そういうところはどう扱うか。
それも非常に重要な観点です。
そういうことで一個一個勉強していかないといけないプロジェクトだと思いますが、大体方向性がわかりましたし、最初どういう目的かと懐疑的だったのですが、こういうことをきちっとやっていくことは非常に重要だとみんなで共通理解されたものと思っております。
それでは、今日の検討されたスケジュール案に沿って、今後、検討項目の検討を進めていきたいと思っております。具体的な検討課題は、本日の議論を踏まえて決定しまして、後日、連絡させていただきます。本日、これで閉会します。
事務局から連絡事項お願いします。
○消費者庁竹田課長 次回の会合は、年明けの1月31日、午前9時半からを予定しています。本日はありがとうございました。
http://www.caa.go.jp/foods/pdf/gijiroku_1.pdf
Posted by 第1回 食品の新たな機能性表示制度に関する検討会(2/2) at 2014年03月17日 10:42









